
Pas njohjes Modeli atomik i Thomson, i cili i konsideronte elektronet të ishin në një mjedis të ngarkuar pozitivisht, një model më i përparuar i njohur si Modeli atomik Rutherford. Shkencëtari i ngarkuar me këtë përparim të ri për shkencën ishte Ernest Rutherford. Ai lindi më 20 gusht 1871 dhe vdiq më 19 tetor 1937. Gjatë jetës së tij ai dha kontribute të mëdha në kimi dhe botën e shkencës në përgjithësi.
Prandaj, ne do ta kushtojmë këtë artikull për t'ju treguar gjithçka që duhet të dini rreth modelit atomik të Rutherfordit.
Eksperimenti i Gjetheve të Arit
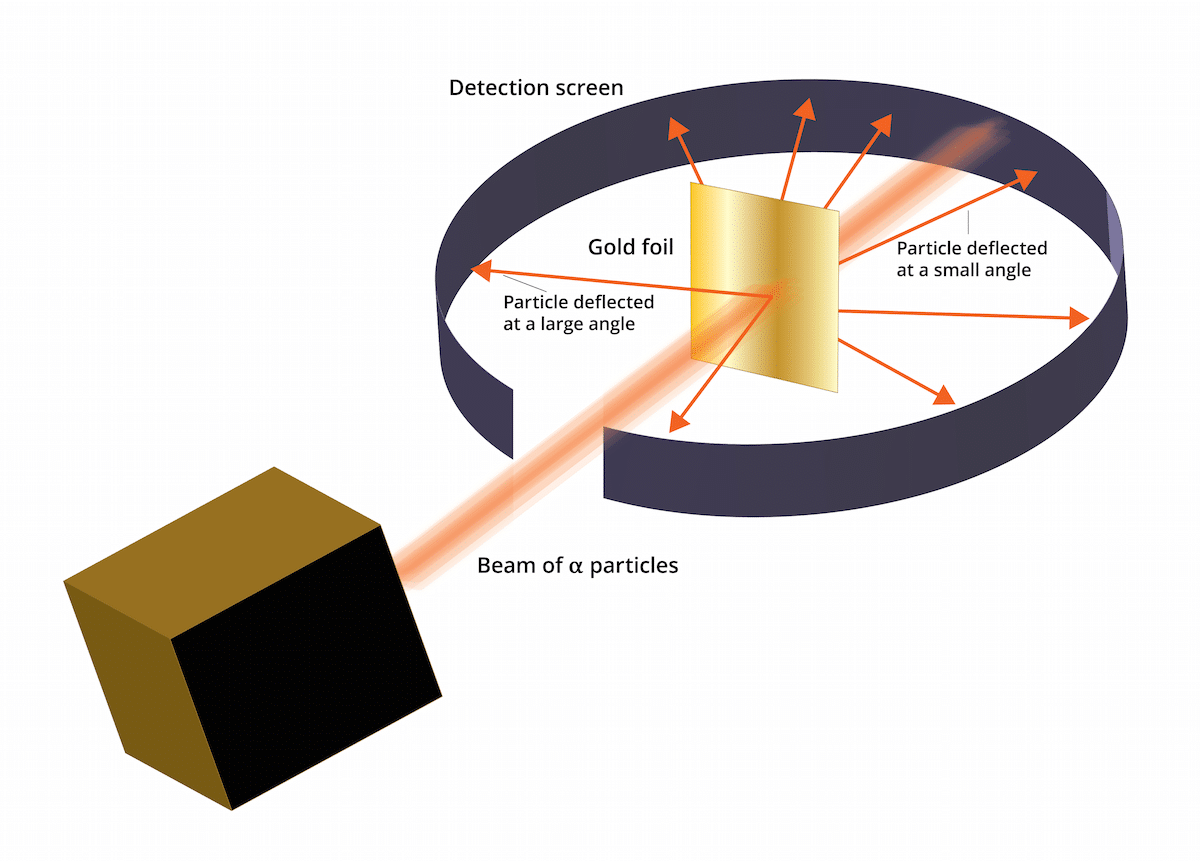
Modeli i vjetër thomson tha që elektronet ishin në një mjedis të ngarkuar pozitivisht. Në 1909 Ernest Rutherford, i shoqëruar nga dy asistentë të quajtur Geiger dhe Marsden, bëri një studim të njohur si eksperimenti i Gjetheve të Artë, ku ata mund të verifikonin që "Pudingu i rrushit" i njohur i Thomson ishte i gabuar. Dhe është se ky eksperiment i ri ishte në gjendje të demonstrojë se atomi kishte një strukturë me një ngarkesë të fortë pozitive. Ky eksperiment nuk mund të ndihmonte për të rindërtuar disa përfundime që përfunduan duke u prezantuar si modeli atomik i Rutherfordit në 1911.
Eksperimenti i njohur si Fletë ari nuk ishte unik, por ato u kryen midis 1909 dhe 1913. Për këtë, ata përdorën laboratorët e fizikës të Universitetit të Mançesterit. Këto eksperimente kishin një rëndësi të madhe pasi përfundimet e reja mund të përcaktoheshin nga rezultatet e tyre, të cilat çuan në një model atomik revolucionar.
Ky eksperiment përbëhej nga sa vijon: një fletë e hollë ari e trashë vetëm 100nm duhej të bombardohej me një sasi të madhe grimcash alfa. Këto grimca alfa ishin dhe jonet. Domethënë, atomet që nuk kanë elektron, kështu që ata kishin vetëm protone dhe neutrone. Duke pasur neutrone dhe protone, ngarkesa totale e atomit ishte pozitive. Ky eksperiment kryesisht kishte si qëllim të mbështeste nëse modeli Thomson ishte i saktë. Nëse ky model do të kishte të drejtë, grimcat alfa duhej të kalonin nëpër atomet e arit në një vijë të drejtë.
Për të studiuar devijimin e shkaktuar nga grimcat alfa, një filtër fluoreshent i sulfurit të zinkut duhej vendosur rreth fletës së artë të imët. Rezultati i këtij eksperimenti është se u vu re se disa grimca ishin në gjendje të kalonin nëpër atomet e arit të fletës në një vijë të drejtë. Sidoqoftë, disa nga këto grimca alfa u devijuan në drejtime të rastësishme.
Përfundimet e eksperimentit të Fletës së Artë

Duke pasur parasysh këtë fakt, nuk ishte e mundur të vërtetohej se çfarë konsiderohen modelet e mëparshme atomike. Dhe është se këto modele atomike theksuan se ngarkesa pozitive u shpërnda në mënyrë të njëtrajtshme në atome dhe kjo do ta bënte më të lehtë kalimin e tij pasi ngarkesa e tij nuk do të ishte aq e fortë në një pikë të caktuar.
Rezultatet e këtij eksperimenti të Fletës së Artë ishin krejtësisht të papritura. Kjo e bëri Rutherford të mendonte se atomi kishte një qendër me një ngarkesë të fortë pozitive e cila bënte kur një grimcë alfa përpiquni ta kaloni atë të refuzuar nga struktura qendrore. Për të krijuar një burim më të besueshëm, grimcat u konsideruan në sasi të atyre që u reflektuan dhe atyre që nuk ishin. Falë kësaj përzgjedhje të grimcave, ishte e mundur të përcaktohej madhësia e bërthamës në krahasim me orbitën e elektroneve përreth saj. Mund të konkludohet gjithashtu se pjesa më e madhe e hapësirës së një atomi është e zbrazët.
Mund të shihej, disa grimca alfa u devijuan nga fleta e artë. Disa prej tyre devijuan vetëm në kënde shumë të vogla. Kjo ndihmoi në përfundimin se ngarkesa pozitive në një atom nuk është shpërndarë në mënyrë të barabartë. Kjo është, ngarkesa pozitive është e vendosur në një atom në një mënyrë të përqendruar në një vëllim shumë të vogël të hapësirës.
Shumë pak grimca alfa tërhiqen prapa. Ky devijim tregon si më poshtë thoshte se grimcat mund të ishin reaguar. Falë gjithë këtyre konsideratave të reja, modeli atomik i Rutherford-it mund të vendoset me ide të reja.
Modeli atomik Rutherford

Ne do të studiojmë cilat janë parimet e modelit atomik të Rutherfordit:
- Grimcat që kanë një ngarkesë pozitive brenda një atomi ato janë rregulluar në një vëllim shumë të vogël nëse e krahasojmë me vëllimin e përgjithshëm të atomit të përmendur.
- Pothuajse e gjithë masa që ka një atom është në atë vëllim të vogël të përmendur. Kjo masë e brendshme quhej bërthama.
- Elektronet që kanë ngarkesa negative ato gjenden duke u rrotulluar rreth bërthamës.
- Elektronet rrotullohen me shpejtësi të lartë kur janë rreth bërthamës dhe e bëjnë këtë në shtigje rrethore. Këto trajektore quheshin orbita. Më vonë do ta bëj ato njihen si orbitale.
- Si ata elektronë që ishin të ngarkuar negativisht, ashtu edhe vetë bërthama e atomit të ngarkuar pozitivisht mbahen së bashku falë forcës tërheqëse elektrostatike.
Pranimi dhe kufizimet e modelit atomik të Rutherfordit
Siç pritej, ky model i ri parashikoi një panoramë krejt të re të atomit në botën shkencore. Falë këtij modeli atomik, shumë shkencëtarë të mëvonshëm mund të studionin dhe përcaktojnë numrin e elektroneve që ka secili element në sistemin periodik. Për më tepër, mund të bëhen zbulime të reja që ndihmojnë në shpjegimin e funksionimit të një atomi në mënyrën më të thjeshtë.
Sidoqoftë, ky model gjithashtu ka disa kufizime dhe mete. Megjithëse ishte një përparim në botën e fizikës, ata nuk ishin as një model i përsosur dhe as i plotë. Dhe a është ajo e sipas ligjeve të Njutonit dhe një aspekt të rëndësishëm të ligjeve të Maksuellit, ky model nuk mund të shpjegonte disa gjëra:
- Ai nuk mund të shpjegonte sesi ngarkesat negative ishin në gjendje të mbanin së bashku në bërthamë. Sipas tibisë elektronike, ngarkesat pozitive duhet të sprapsin njëra-tjetrën.
- Një kontradiktë tjetër ishte drejt ligjeve themelore të elektrodinamikës. Nëse elektronet me një ngarkesë pozitive konsiderohet se rrotullohen rreth bërthamës, ato duhet të lëshojnë rrezatim elektromagnetik. Duke emetuar këtë rrezatim, harxhohet energji që elektronet të shemben në bërthamë. Prandaj, modeli atomik i strijuar nuk mund të shpjegojë stabilitetin e atomit.
Shpresoj që me këtë informacion të mësoni më shumë rreth modelit atomik të Rutherfordit.