
La Ligji i Boyle ai u zbulua nga Robert Boyle në shekullin e XNUMX-të dhe hodhi themelet për të shpjeguar marrëdhënien midis presionit dhe vëllimit të pranishëm në gaze. Nëpërmjet një sërë eksperimentesh, ai arriti të tregojë se nëse temperatura është konstante, një gaz zvogëlon vëllimin e tij kur i nënshtrohet më shumë presionit dhe rritet në vëllim nëse presioni zvogëlohet.
Në këtë artikull do t'ju tregojmë gjithçka që duhet të dini për ligjin e Boyle, karakteristikat dhe rëndësinë e tij.
tipare kryesore
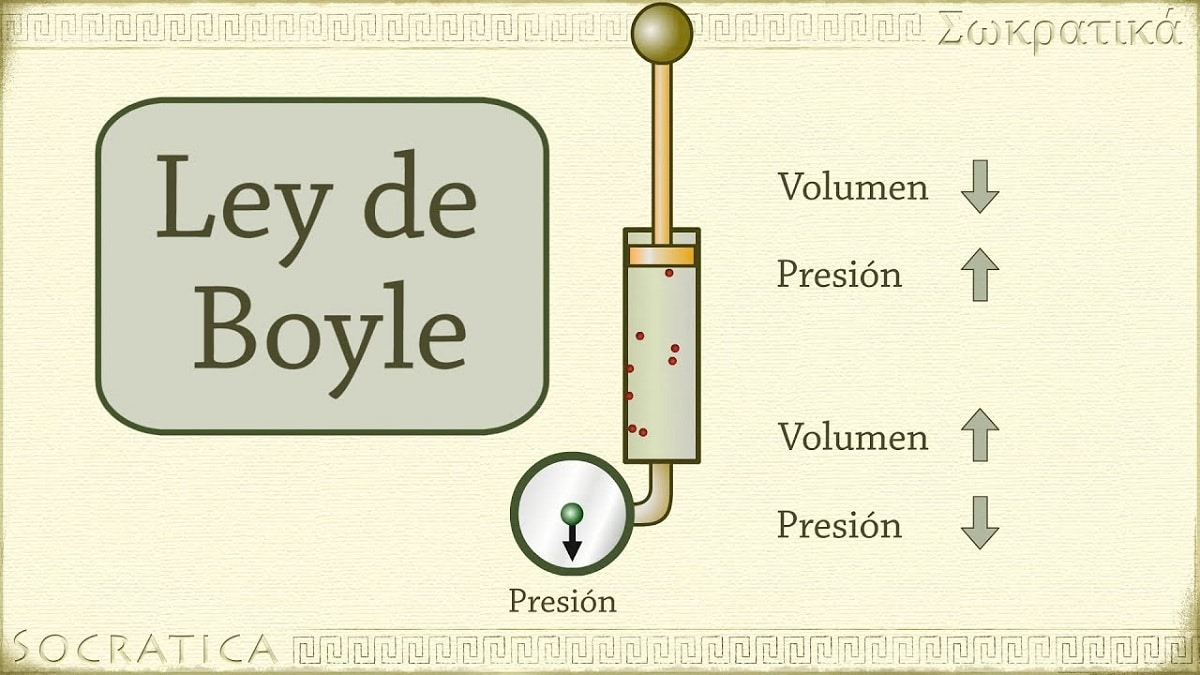
Në 1662, Robert Boyle zbuloi se presioni i ushtruar mbi një gaz është në përpjesëtim të zhdrejtë me vëllimin e tij dhe numrin e moleve në temperaturë konstante. Me fjalë të tjera, nëse presioni i aplikuar në një gaz dyfishohet, i njëjti gaz do të ngjeshet dhe vëllimi i tij do të përgjysmohet.
Me rritjen e vëllimit të enës që përmban gazin, rritet edhe distanca që grimcat duhet të kalojnë përpara se të përplasen me muret e enës. Kjo rritje në distancë lejon që frekuenca e goditjeve të ulet, kështu që presioni në mur është më i vogël se më parë kur vëllimi ishte më i vogël.
Ligji i Boyle u zbulua për herë të parë në 1662 nga Robert Boyle. Edme Mariotte ishte një tjetër shkencëtare që mendoi dhe arriti në të njëjtat përfundime si Boyle, megjithatë, Mariotte nuk e bëri publike veprën e tij deri në vitin 1676. Kjo është arsyeja pse në shumë libra gjejmë këtë ligj të quajtur Ligji i Boyle dhe Mariot Ligji i Boyle-Mariot, i njohur gjithashtu si Ligji i Mattut, i zhvilluar nga fizikani dhe kimisti britanik Robert Ai u formulua në mënyrë të pavarur nga Boyle dhe fizikani dhe botanisti francez Edmé Mattout.
Ai i referohet njërit prej ligjeve që lidhin vëllimin dhe presionin e një gazi me një sasi të caktuar gazi të mbajtur në një temperaturë konstante. Ligji i Boyle-it thotë si më poshtë: Presioni i ushtruar nga një forcë është fizikisht në proporcion të zhdrejtë me vëllimin e lëndës së gaztë për sa kohë që temperatura e saj mbetet konstante. Ose më thjesht, mund ta interpretojmë si: në një temperaturë më të lartë konstante, vëllimi i një mase fikse gazi është në përpjesëtim të zhdrejtë me presionin konstant që ushtron.
Eksperimente dhe zbatime të ligjit të Boyle

Për të vërtetuar teorinë e Ligjit të Boyle, Mariot ishte përgjegjës për futjen e gazit në një cilindër me një piston dhe ishte në gjendje të verifikonte presionet e ndryshme që krijoheshin kur pistoni zbriste. Nga ky eksperiment rezulton se me rritjen e vëllimit, presioni zvogëlohet.
Ligji i Boyle ka shumë zbatime në jetën moderne, ndër të cilat mund të përmendim për shembull zhytjen, kjo sepse zhytësi duhet të nxjerrë ajrin nga mushkëritë e tij kur ngjitet sepse zgjerohet kur presioni ulet, nëse duke mos e bërë këtë mund të shkaktojë dëmtim të indeve.
Gjendet në të gjitha pajisjet që përdorin ose fuqizohen nga fuqia pneumatike, të tilla si krahët robotikë që përdorin komponentë të tillë si pistonët pneumatikë, aktivizuesit, rregullatorët e presionit dhe valvulat e lehtësimit të presionit.
Motorët me benzinë, gaz ose naftë përdorin ligjin e Boyle-it edhe gjatë djegies së brendshme, sepse herën e parë që ajri hyn në cilindër me vëllim dhe presion, herën e dytë zvogëlon vëllimin duke rritur presionin.
Makinat kanë sisteme airbag që funksionojnë duke nxjerrë jashtë një sasi të caktuar ajri ose gazi nga një dhomë që arrin në airbag të jashtëm, ku presioni ulet dhe vëllimi rritet duke mbajtur një temperaturë konstante.
Ligji i Boyle është shumë i rëndësishëm sot sepse është ligji ai që na flet dhe shpjegon sjelljen e gazeve. Ai definitivisht shpjegon se presioni dhe vëllimi i një gazi janë në përpjesëtim të zhdrejtë me njëri-tjetrin. Prandaj, kur presioni ushtrohet në një gaz, vëllimi i tij zvogëlohet dhe presioni i tij rritet.
modeli ideal i gazit

Ligji Boyle-Mariotte zbatohet për të ashtuquajturat gaze ideale, një model teorik që thjeshton shumë sjelljen e çdo gazi, duke supozuar:
- molekulat e gazit ato janë aq të vogla sa nuk është e nevojshme të mendosh për madhësinë e tyre, sidomos duke pasur parasysh se kjo është shumë më e vogël se distanca që ata udhëtojnë.
- Përveç kësaj, molekulat mezi ndërveprojnë, me përjashtim të rasteve kur ato përplasen shumë shkurt, dhe kur përplasen, përplasja është elastike, kështu që si momenti ashtu edhe energjia kinetike ruhen.
- Së fundi, supozojmë se kjo energji kinetike është proporcionale me temperaturën e kampionit të gaztë, d.m.th. sa më shumë të trazuara të jenë grimcat, aq më e lartë është temperatura.
Gazrat e lehta, pavarësisht nga identiteti i tyre, ndjekin këto udhëzime në mënyrë shumë strikte në kushte standarde të temperaturës dhe presionit (p.sh.: 0ºC dhe presioni atmosferik (1 atmosferë). Për këto gaze, ligji Boyle-Mariotte përshkruan sjelljen e tyre shumë saktë. .
Meqenëse P∙V është konstante në një temperaturë të caktuar, nëse presioni i gazit ndryshon, vëllimi ndryshon në mënyrë që produkti të mbetet i njëjtë, kështu që në dy gjendje të ndryshme 1 dhe 2, barazia mund të shprehet si më poshtë:
P1∙V1 = P2∙V2
Më pas, duke ditur një gjendje, plus një ndryshore nga gjendja tjetër, mund të njihni variablin që mungon duke e hequr atë nga ligji Boyle-Mariot.
Historia e ligjit të Boyle
kimist britanik. Pionier i eksperimenteve në fushën e kimisë, veçanërisht në vetitë e gazeve,
Teza e Robert Boyle mbi sjelljen e materies në nivelin e grimcave ishte një pararendës i teorisë moderne të elementeve kimike. Ai ishte gjithashtu një anëtar themelues i Shoqërisë Mbretërore të Londrës.
Robert Boyle lindi në një familje fisnike në Irlandë dhe ndoqi shkollat më të mira angleze dhe evropiane. Nga viti 1656 deri në 1668 ai shërbeu si asistent i Robert Hooke në Universitetin e Oksfordit, duke bashkëpunuar me të në një seri eksperimentesh që përcaktuan vetitë fizike të ajrit dhe mënyrën se si ai digjet, merr frymë dhe transmeton zërin.
Rezultatet e këtyre kontributeve u grumbulluan në to “Eksperimente të reja fiziko-mekanike mbi elasticitetin e ajrit dhe efektet e tij» (1660). Në botimin e dytë të kësaj vepre (1662), ai zbuloi vetinë e famshme të gazeve, ligjin Boyle-Mariotte, i cili thoshte se vëllimi i zënë nga një gaz në temperaturë konstante është në përpjesëtim të zhdrejtë me presionin e tij. Sot dihet se ky ligj përmbushet vetëm kur pranohet sjellja teorike ideale e gazeve.
Shpresoj që me këtë informacion të mund të mësoni më shumë për ligjin e Boyle, karakteristikat dhe aplikimet e tij në botën e shkencës.