
Atomi është njësia bazë e materies dhe është fraksioni më i vogël që mund të identifikojë një element kimik. Ai përbëhet nga një bërthamë atomike që përmban neutrone dhe protone, dhe elektrone që rrethojnë bërthamën. Termi atom rrjedh nga greqishtja dhe do të thotë i pandashëm. Megjithatë, shumë njerëz nuk e dinë mirë Çfarë është një atom as cilat janë karakteristikat e tij.
Prandaj, ne do t'jua kushtojmë këtë artikull për t'ju treguar se çfarë është një atom, karakteristikat dhe rëndësia e tij.
Çfarë është një atom

Atomet përbëhen nga një pjesë qendrore e quajtur bërthama, në të cilën banojnë protonet (grimcat e ngarkuara pozitivisht) dhe neutronet (grimcat elektrike neutrale). Rajoni rreth bërthamës është i zënë nga elektronet (grimcat e ngarkuara negativisht); ky rajon quhet shtresa elektrike. Predha elektrike (e ngarkuar negativisht) dhe bërthama (e ngarkuar pozitivisht) mbahen së bashku nga tërheqja elektrike.
Diametri mesatar i një atomi është rreth 10-10 metra, dhe diametri mesatar i një bërthame është rreth 10-15 metra; kështu që, një atom ka një diametër prej 10.000 deri në 100.000 herë më të madh se bërthama e tij. Për shembull, nëse një atom është sa madhësia e një fushe futbolli, bërthama do të jetë e njëjtë me madhësinë e topit në qendër të fushës. Nëse një atom është 100 metra në diametër, bërthama e tij është 1 centimetër në diametër.
Disa histori

Filozofi grek Aristoteli (384 para Krishtit – 322 para Krishtit) u përpoq të shpjegonte përbërjen e të gjithë materies nga elementët: toka, ajri, zjarri dhe uji. Demokriti (546 para Krishtit – 460 para Krishtit) ishte një shkencëtar dhe matematikan grek që propozoi idenë se kishte një kufi për madhësinë e grimcave. Këto grimca bëhen aq të vogla sa nuk mund të ndahen më, tha ai. Ai i quajti grimca të tilla "atome".
Për pjesën më të madhe të shekullit të XNUMX-të, ishte modeli atomik i shkencëtarit britanik Dalton që propozoi teorinë atomike, e cila ishte shumë përtej mendimit të të lashtëve në atë kohë.
Kjo teori thotë se E gjithë lënda përbëhet nga grimca të vogla të pandashme të quajtura atome. Hulumtimet e fundit kanë zbuluar se atomet përbëhen nga grimca të tjera të vogla të quajtura grimca subatomike.
Historikisht, teori të ndryshme atomike mbi përbërjen e materies janë zhvilluar përpara se të merreshin njohuritë aktuale mbi strukturën atomike. Bazuar në teorinë atomike, Shkencëtarët kanë demonstruar modele të atomeve që evoluojnë gradualisht.
Modeli i parë i propozuar nga John Dalton u zhvillua në modelin e atomit të Niels Bohr. Bohr propozoi një model shumë të ngjashëm me modelin aktual të elektroneve që rrotullohen rreth bërthamës.
struktura e një atomi
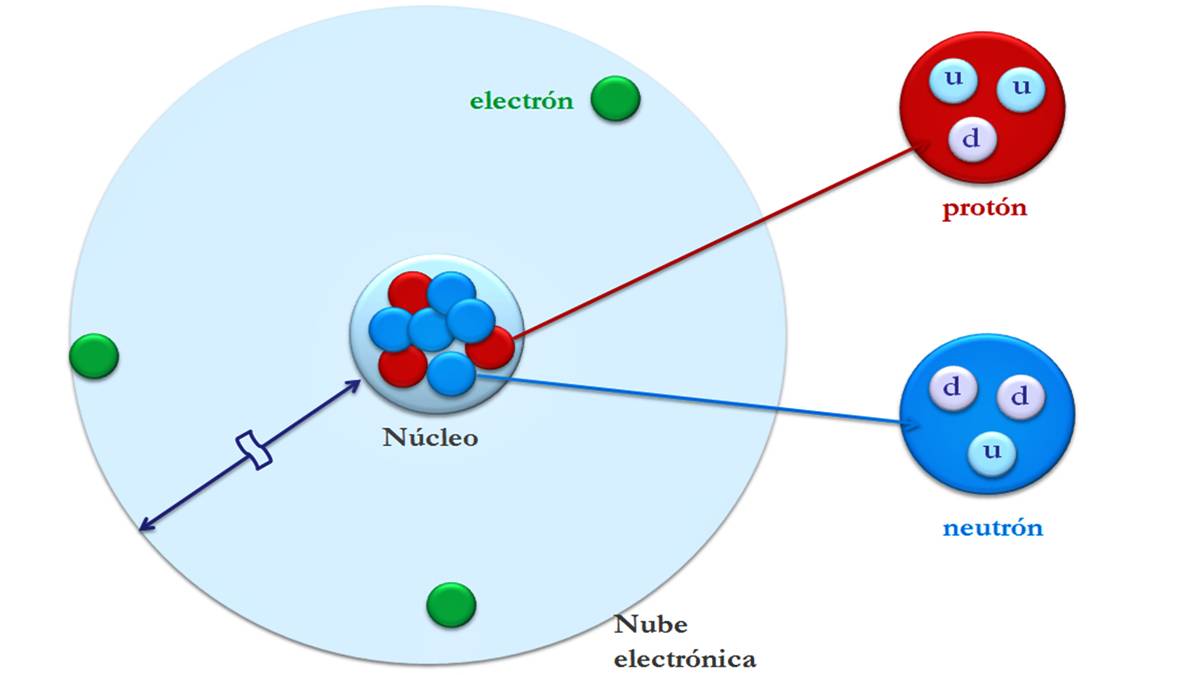
Atomet përbëhen nga grimca të vogla të quajtura grimca nënatomike: elektrone, protone dhe neutrone. Pjesa më e madhe e masës së një atomi është e përqendruar në bërthamë. Dhe vëllimi i tij më i madh është në shtresën elektrike ku gjenden elektronet.
Elektrone, protone dhe neutrone
Elektronet janë të ngarkuar negativisht dhe nuk kanë pothuajse asnjë masë. Masa e saj është rreth 1840 herë më e madhe se ajo e bërthamës atomike.. Ato janë grimca të vogla që rrotullohen rreth bërthamës qendrore të një atomi. Përveç kësaj, ata lëvizin me shpejtësi rreth bërthamës duke gjeneruar një fushë elektromagnetike.
Një proton ka të njëjtën ngarkesë pozitive si ngarkesa në një elektron në vlerë absolute, kështu që protonet dhe elektronet priren të tërheqin njëri-tjetrin. Këto përbëjnë njësinë e masës dhe së bashku me neutronet formojnë bërthamën e atomit.
Neutronet nuk kanë ngarkesë, domethënë kanë ngarkesë neutrale. Së bashku me protonet, ajo formon bërthamën dhe përfaqëson pothuajse të gjithë masën (99,9%) të atomit. Neutronet sigurojnë stabilitet në bërthamë.
Atomet kanë nivele energjie, shtatë predha rreth bërthamës në të cilat ka elektrone që rrotullohen rreth bërthamës. Predhat janë emërtuar K, L, M, N, O, P dhe Q. Çdo predhë mund të mbajë një numër të kufizuar elektronesh: tetë elektrone për shtresë. Shtresa më e jashtme është gjithmonë më dinamike. Vetëm atomi i hidrogjenit nuk ka neutrone dhe vetëm një elektron rrotullohet rreth protonit.
karakteristikat kimike
Në kimi, atomet janë njësitë themelore që zakonisht ruajnë vetitë e tyre origjinale në çdo reagim. Ato nuk shkatërrohen apo krijohen, thjesht janë të rregulluara në mënyra të ndryshme me lidhje të ndryshme mes tyre.
Atomet grumbullohen së bashku për të krijuar molekula dhe lloje të tjera materialesh. Lidhjet e krijuara në reaksionet kimike kanë një përbërje të caktuar që dallon elementët e ndryshëm kimikë. Këta elementë janë ata që shfaqen në tabelën periodike të elementeve.
Secili prej këtyre elementeve ka shumë protone në bërthamë. Ky numër quhet numër atomik dhe shënohet me shkronjën Z. Të gjithë atomet me numër të njëjtë të protoneve i përkasin të njëjtit element dhe kanë të njëjtat veti kimike edhe pse janë elementë kimikë të ndryshëm.
Për më tepër, gjejmë numrin masiv, të shënuar me shkronjën A. Ky numër i referohet numrit të nukleoneve të pranishëm në atom. Një lloj tjetër atomi që mund të gjejmë, dhe për të cilin dimë më mirë, është një izotop. Këto atome kanë të njëjtin numër protonesh, por numër të ndryshëm neutronesh. Ata kanë të njëjtat veti kimike edhe pse vetitë e tyre fizike janë të ndryshme nga njëra-tjetra.
Siç u përmend më herët, izotopët janë shumë të rëndësishëm. Dhe ato janë jetike për energjinë bërthamore, sepse pasurimi i uraniumit përfshin konvertimin e një izotopi të uraniumit në një tjetër me një strukturë kimike më të paqëndrueshme, duke na lejuar të kemi një reaksion zinxhir.
Prona të paluajtshme
Vetitë që përcaktojnë një atom janë:
- Numri atomik (Z) që tregon numrin e protoneve në bërthamë. Të gjithë atomet me numër të njëjtë të protoneve i përkasin të njëjtit element. Për shembull, një atom hidrogjeni me vetëm një proton.
- Numri i masës i referohet shumës së protoneve dhe neutroneve.. Elementet me numër të ndryshëm neutronesh janë izotopë të ndryshëm të të njëjtit element.
- elektronegativiteti Është tendenca e atomeve për të tërhequr elektrone kur ato formojnë lidhje kimike.
- rrezja atomike Ajo korrespondon me gjysmën e distancës midis dy bërthamave të bashkuara të të njëjtit element.
- potenciali jonizues Është energjia e nevojshme për të hequr një elektron nga një element.
Shpresoj që me këtë informacion të mund të mësoni më shumë se çfarë është një atom dhe karakteristikat e tij.
SHUME MIRE
Ricardo