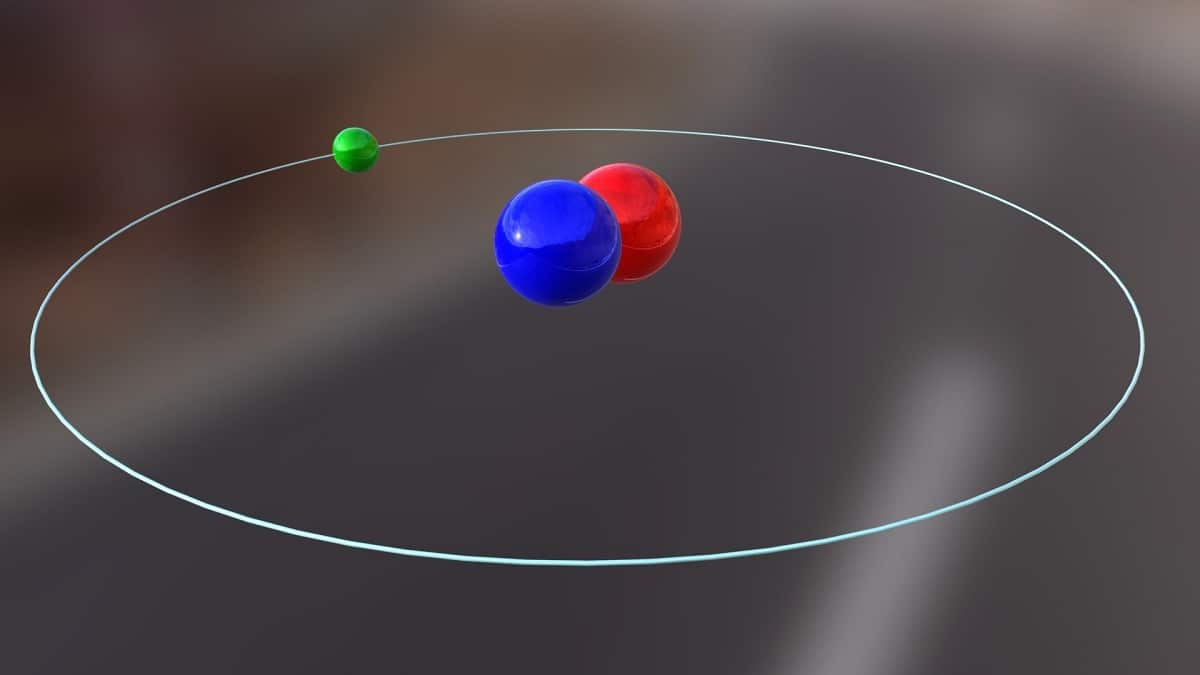
આજે આપણે એવા આઇસોટોપ વિશે વાત કરવા જઈ રહ્યા છીએ જેનો ઉપયોગ અણુ produceર્જા ઉત્પન્ન કરવા માટે થાય છે. તે વિશે ડ્યુટેરિયમ. તે હાઇડ્રોજનની આઇસોટોપ જાતિઓમાંની એક છે અને ડી અથવા દ્વારા પ્રતીક દ્વારા રજૂ થાય છે 2એચ. તેને હેવી હાઇડ્રોજનનું સામાન્ય નામ આપવામાં આવ્યું છે, કારણ કે તે સમૂહ પ્રોટોન કરતા બમણો છે. આઇસોટોપ એ પ્રજાતિ સિવાય બીજું કશું નથી જે એક જ રાસાયણિક તત્વમાંથી આવે છે પરંતુ તેની સમૂહ જુદી જુદી હોય છે. ડ્યુટેરિયમનો ઉપયોગ વિવિધ હેતુઓ માટે થાય છે.
તેથી, અમે તમને ડ્યુટેરિયમની બધી લાક્ષણિકતાઓ, બંધારણ, ગુણધર્મો અને ઉપયોગો વિશે જણાવવા આ લેખ સમર્પિત કરવા જઈ રહ્યા છીએ.
મુખ્ય લાક્ષણિકતાઓ
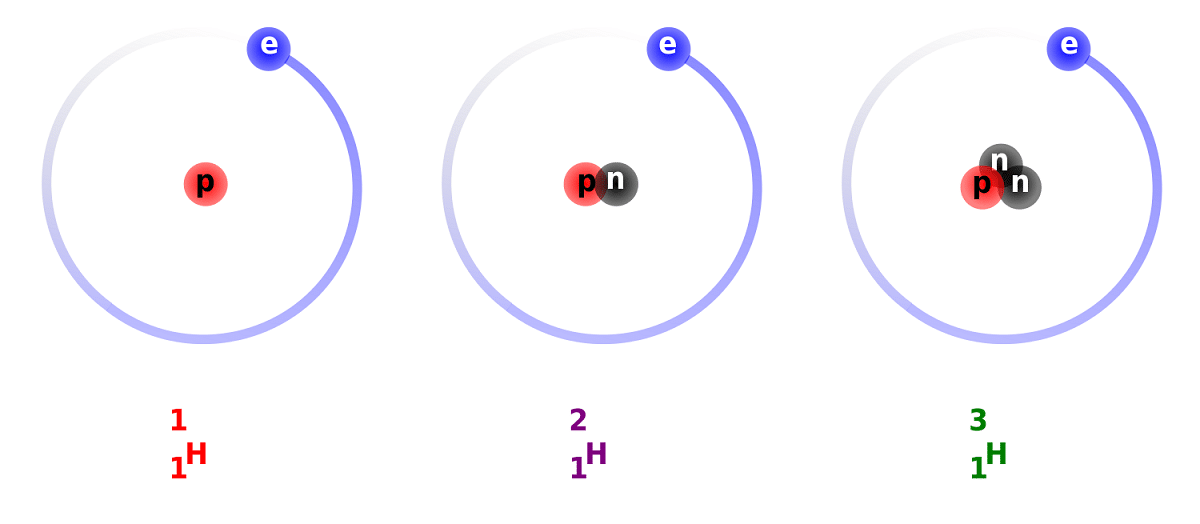
ડ્યુટેરિયમ અને હાઇડ્રોજન વચ્ચેનો તફાવત તેના ન્યુટ્રોનની સંખ્યાના તફાવતને કારણે છે. આ કારણોસર, ડ્યુટેરિયમ એક સ્થિર આઇસોટોપ માનવામાં આવે છે અને તદ્દન કુદરતી મૂળના હાઇડ્રોજન દ્વારા રચાયેલ સંયોજનોમાં મળી શકે છે. તે ધ્યાનમાં લેવું આવશ્યક છે કે, તેઓ કુદરતી મૂળના હોવા છતાં, તેઓ ઓછા પ્રમાણમાં થાય છે. સામાન્ય હાઇડ્રોજનની જેમ સમાન ગુણધર્મો આપવામાં, તે ભાગ લે છે તે પ્રતિક્રિયાઓમાં તેના સંપૂર્ણતામાં તેને બદલી શકે છે. આ રીતે, તે સમકક્ષ પદાર્થોમાં ફેરવી શકાય છે.
આ અને અન્ય કારણોસર, ડ્યુટેરિયમ પાસે વિજ્ .ાનના વિવિધ ક્ષેત્રોમાં મોટી સંખ્યામાં એપ્લિકેશન છે. તે વર્ષોથી સંશોધન અને તકનીકી અને માહિતીમાં આગળ વધવા માટેનું એક મહત્વપૂર્ણ ઘટક બની ગયું છે.
આ આઇસોટોપની મુખ્ય રચના એક ન્યુક્લિયસથી બનેલી છે જેમાં પ્રોટોન અને ન્યુટ્રોન હોય છે. તેનું અણુ વજન આશરે 2,014 ગ્રામ છે. આ આઇસોટોપ, 1931 માં યુનાઇટેડ સ્ટેટ્સના રસાયણશાસ્ત્રી હેરોલ્ડ સી. યુરે અને તેના સહયોગીઓ ફર્ડિનાન્ડ બ્રિકવેડ્ડ અને જ્યોર્જ મર્ફીના આભાર માની લેવામાં આવ્યો હતો. ડ્યુટેરિયમને તેની શુદ્ધ સ્થિતિમાં મળવાની તૈયારી 1933 માં પ્રથમ વખત સફળતાપૂર્વક હાથ ધરવામાં આવી હતી. તે પહેલેથી જ 50 ના દાયકાની છે જ્યારે એક નક્કર તબક્કો કે જેણે લિથિયમ ડિટ્યુરાઇડ તરીકે ઓળખાતું મહાન સ્થિરતા દર્શાવ્યું, તેનો ઉપયોગ શરૂ થયો. આ પદાર્થ મોટી સંખ્યામાં રાસાયણિક પ્રતિક્રિયામાં ડ્યુટેરિયમ અને ટ્રિટિયમને બદલી શકે છે.
વિજ્ inાનમાં પ્રગતિ થાય છે જ્યારે કોઈ પદાર્થ મળે છે જે ઉત્પાદનોના ઉત્પાદન માટે રાસાયણિક પ્રતિક્રિયાઓને સરળ બનાવી શકે છે. આ અર્થમાં, જો તમે અમુક વસ્તુઓનું નિરીક્ષણ કરી શકવા માટે આ આઇસોટોપની વિપુલતાનો અભ્યાસ કરો છો. તે જાણીતું રહ્યું છે કે પાણીમાં ડ્યુટેરિયમનું પ્રમાણ જ્યાં નમૂના લેવામાં આવે છે તેના આધારે થોડું બદલાય છે. કેટલાક સ્પેક્ટ્રોસ્કોપી અભ્યાસ છે કે આપણા ગેલેક્સીના અન્ય ગ્રહો પર આ આઇસોટોપનું અસ્તિત્વ નક્કી કર્યું છે. અન્ય અવકાશી પદાર્થોની રચનાનો અભ્યાસ કરવા માટે આ ખૂબ મહત્વનું હોઈ શકે છે.
ડ્યુટેરિયમની રચના અને મૂળ

આપણે ડ્યુટેરિયમ વિશે કેટલીક તથ્યો જાણવા જઈશું. જેમ આપણે પહેલા કહ્યું છે, હાઇડ્રોજન આઇસોટોપ્સ વચ્ચેનો મુખ્ય તફાવત તેમની રચનામાં રહેલો છે. અને તે છે કે હાઇડ્રોજન, ડ્યુટેરિયમ અને ટ્રિટિયમમાં વિવિધ પ્રમાણમાં પ્રોટોન અને ન્યુટ્રોન હોય છે, તેથી તેમની પાસે વિવિધ રાસાયણિક ગુણધર્મો છે. મારે એ પણ ધ્યાનમાં રાખવું પડશે કે અન્ય તારાઓની સંસ્થાઓ અંદર જે ડ્યુટેરિયમ હોય છે તે ઉત્પન્ન થયા કરતા વધારે ઝડપે કા eliminatedી નાખવામાં આવે છે. આ એક કારણ છે કે તારાઓની સંસ્થાઓમાં ડ્યુટેરિયમની હાજરીનો અભ્યાસ કરવો તે કેમ મુશ્કેલ છે.
પ્રકૃતિના અન્ય અસાધારણ ઘટનામાં ડ્યુટેરિયમની થોડી માત્રાની રચના કરવામાં આવે છે, તેથી તેનું ઉત્પાદન આજે પણ નોંધપાત્ર રસ ઉત્પન્ન કરે છે. પ્રકૃતિમાં ડ્યુટેરિયમની હાજરી વિશે આપણે જે ટકાવારીનો ઉલ્લેખ કર્યો છે તેમાંથી, તે 0.02% જેટલું નથી. વૈજ્ scientificાનિક તપાસની શ્રેણીમાં બહાર આવ્યું છે કે ડ્યુટેરિયમમાંથી બનાવવામાં આવેલા મોટાભાગના અણુઓ વિસ્ફોટથી ઉત્પન્ન થયા છે જેણે બ્રહ્માંડના મૂળ તરીકે ઓળખાય છે તરીકે ઓળખાય છે મહાવિસ્ફોટ. આ મુખ્ય કારણોમાંનું એક કારણ છે કે બૃહસ્પતિ જેવા મોટા ગ્રહોમાં ડ્યુટેરિયમ હોવાનું માનવામાં આવે છે.
આ આઇસોટોપને કુદરતી રીતે મેળવવાની સૌથી સામાન્ય રીત જ્યારે તેઓ હાઇડ્રોજન સાથે જોડાય છે. જ્યારે આવું થાય છે, ત્યારે તે પ્રોટીમના રૂપમાં જોડવામાં આવશે. વૈજ્ .ાનિકો તે સંબંધને જાણવા માટે રસ ધરાવે છે જે પ્રમાણના પ્રમાણ વચ્ચે સ્થાપિત થયેલ છે વિજ્ ofાનના વિવિધ ક્ષેત્રોમાં ડ્યુટેરિયમ અને હાઇડ્રોજન. એસ્ટ્રોનોમી અથવા ક્લાઇમેટોલોજી જેવી વિજ્ ofાનની શાખાઓમાં તેનો વ્યાપકપણે અભ્યાસ કરવામાં આવે છે. આ શાખાઓમાં બ્રહ્માંડ અને આપણા વાતાવરણને જાણવા અને સમજવા માટે તેની કેટલીક વ્યવહારિક ઉપયોગિતાઓ છે.
ડ્યુટેરિયમ ગુણધર્મો

આપણે જાણીશું કે હાઇડ્રોજનથી સંબંધિત આ આઇસોટોપ મુખ્ય ગુણધર્મો શું છે. સૌ પ્રથમ એ જાણવાનું છે કે કિરણોત્સર્ગી લાક્ષણિકતાઓથી મુક્ત કોઈ આઇસોટોપ શું છે. આનો અર્થ એ કે તે પ્રકૃતિમાં એકદમ સ્થિર છે. તેનો ઉપયોગ વિવિધ રાસાયણિક પ્રતિક્રિયાઓમાં હાઇડ્રોજનને બદલવા માટે થઈ શકે છે. કુદરતી રીતે મહાન સ્થિરતા રાખીને, સામાન્ય હાઇડ્રોજન માટે જુદું વર્તન બતાવે છે. આ બાયોકેમિકલ પ્રકૃતિ ધરાવતા તમામ પ્રતિક્રિયાઓમાં થાય છે. અવેજી કરતા પહેલા તે જાણવું જરૂરી છે, કેમ કે રાસાયણિક પ્રતિક્રિયાઓમાં ડ્યુટેરિયમ માટે હાઇડ્રોજનની આપલે કરીને તે પહોંચી શકાય છે, તે જાણવું જ જોઇએ કે તેમની પાસે જુદું વર્તન હશે.
જ્યારે તમે પાણીમાં બે હાઇડ્રોજન પરમાણુ બદલો છો, ત્યારે તમે એક સંયોજન મેળવી શકો છો જેને ભારે પાણી તરીકે ઓળખવામાં આવે છે. હાઇડ્રોજન જે સમુદ્રમાં હાજર છે અને તે ડ્યુટેરિયમના સ્વરૂપમાં છે તે માત્ર પ્રોટિયમના સંબંધમાં 0,016% નું પ્રમાણ રજૂ કરે છે. બ્રહ્માંડમાં, આ આઇસોટોપ હિલીયમને ઉત્તેજના આપવા માટે વધુ ઝડપથી ફ્યુઝ કરવાની વૃત્તિ ધરાવે છે. જો આપણે ડ્યુટેરિયમને અણુ oxygenક્સિજન સાથે જોડીએ તો આપણે જોઈએ છીએ કે તે એક ઝેરી જાતિ બની જાય છે. આ હોવા છતાં, અને રાસાયણિક ગુણધર્મો અથવા હાઇડ્રોજનની જેમ ખૂબ સમાન છે.
આ આઇસોટોપનો બીજો ગુણધર્મ એ છે કે જ્યારે uterંચા તાપમાને ડ્યુટેરિયમ અણુઓ પરમાણુ ફ્યુઝન પ્રક્રિયાને આધિન હોય ત્યારે, મોટી માત્રામાં energyર્જા મુક્ત થઈ શકે છે. તે હિજરત છે, તમે આપણા ગ્રહના પરમાણુ ફ્યુઝનને લાગુ કરવામાં સક્ષમ થવાનો અભ્યાસ કર્યો છે. કેટલાક શારીરિક ગુણધર્મો જેમ કે ઉકળતા બિંદુ, વરાળની ગરમી, ટ્રિપલ પોઇન્ટ અને ઘનતા હાઇડ્રોજન કરતા વધારે તીવ્રતા ધરાવે છે.
હું આશા રાખું છું કે આ માહિતી સાથે તમે ડ્યુટેરિયમ અને તેની લાક્ષણિકતાઓ વિશે વધુ શીખી શકો છો.