
அறிமுகமான பிறகு தாம்சனின் அணு மாதிரி, இது எலக்ட்ரான்களை நேர்மறையாக சார்ஜ் செய்யப்பட்ட ஊடகமாகக் கருதுகிறது, இது மிகவும் மேம்பட்ட மாதிரி என அழைக்கப்படுகிறது ரதர்ஃபோர்ட் அணு மாதிரி. அறிவியலுக்கான இந்த புதிய முன்னேற்றத்திற்கு பொறுப்பான விஞ்ஞானி எர்னஸ்ட் ரதர்ஃபோர்ட் ஆவார். அவர் ஆகஸ்ட் 20, 1871 இல் பிறந்தார், அக்டோபர் 19, 1937 இல் இறந்தார். அவரது வாழ்நாளில் வேதியியல் மற்றும் பொதுவாக அறிவியல் உலகிற்கு பெரும் பங்களிப்புகளைச் செய்தார்.
எனவே, ரதர்ஃபோர்டின் அணு மாதிரியைப் பற்றி நீங்கள் தெரிந்து கொள்ள வேண்டிய அனைத்தையும் உங்களுக்குச் சொல்ல இந்த கட்டுரையை நாங்கள் அர்ப்பணிக்கப் போகிறோம்.
தங்க இலை பரிசோதனை
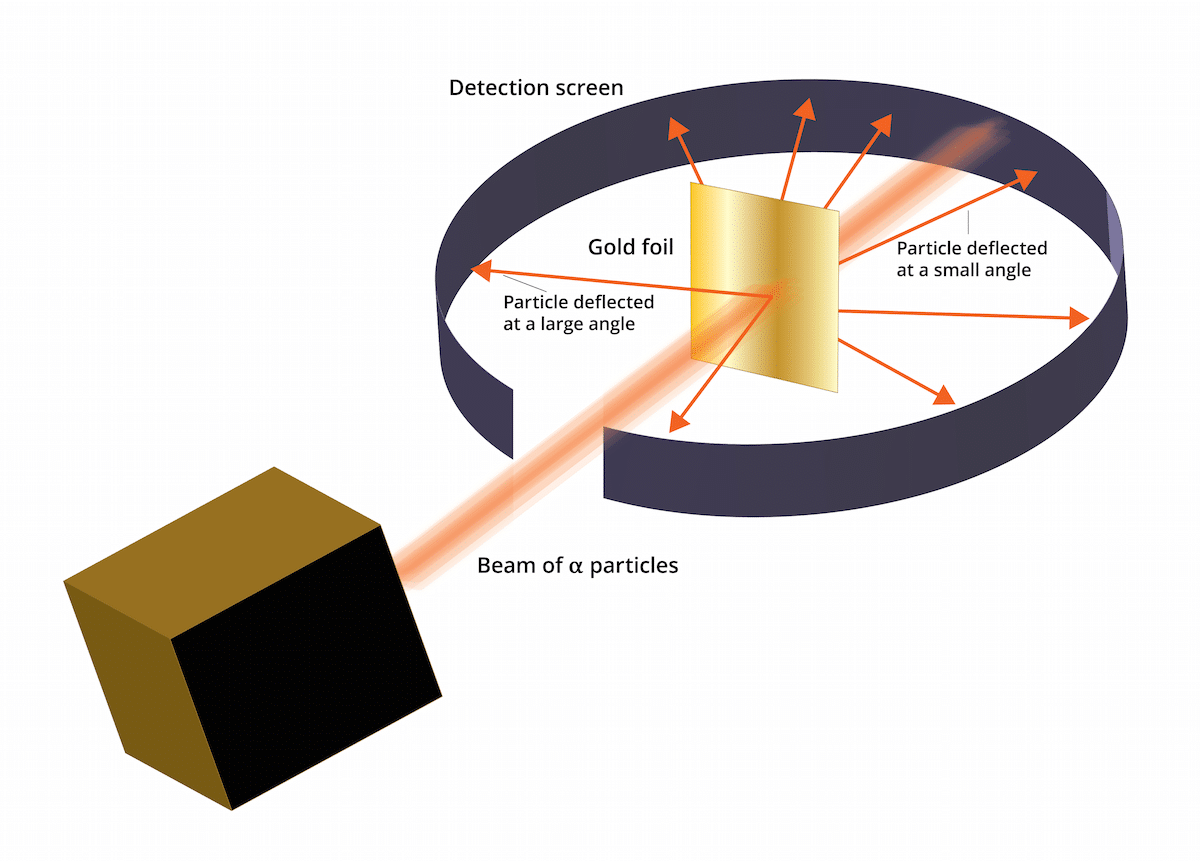
எலக்ட்ரான்கள் நேர்மறையாக சார்ஜ் செய்யப்பட்ட ஊடகத்தில் இருப்பதாக பழைய தாம்சன் மாதிரி கூறியது. 1909 ஆம் ஆண்டில், ஏர்னெஸ்ட் ரதர்ஃபோர்ட், கீகர் மற்றும் மார்ஸ்டன் என்ற இரண்டு உதவியாளர்களுடன் சேர்ந்து, தங்க இலை சோதனை என்று அழைக்கப்படும் ஒரு ஆய்வை மேற்கொண்டார், அங்கு அவர்கள் அதைச் சரிபார்க்க முடிந்தது தாம்சனின் நன்கு அறியப்பட்ட "திராட்சை புட்டு" தவறு. இந்த புதிய பரிசோதனையானது அணுவில் ஒரு வலுவான நேர்மறை கட்டணத்துடன் ஒரு அமைப்பைக் கொண்டுள்ளது என்பதைக் காட்ட முடிந்தது. இந்த சோதனை அல்லது 1911 ஆம் ஆண்டில் ரதர்ஃபோர்டின் அணு மாதிரியாக வழங்கப்பட்ட சில முடிவுகளை மீண்டும் நிறுவ உதவும்.
இலை தங்கம் என்று அழைக்கப்படும் சோதனை தனித்துவமானது அல்ல, ஆனால் அவை 1909 மற்றும் 1913 க்கு இடையில் மேற்கொள்ளப்பட்டன. இதற்காக, அவர்கள் பயன்படுத்தினர் மான்செஸ்டர் பல்கலைக்கழகத்தின் இயற்பியல் ஆய்வகங்கள். அவற்றின் முடிவுகளிலிருந்து புதிய முடிவுகளை நிறுவ முடியும் என்பதால் இந்த சோதனைகள் மிகவும் முக்கியத்துவம் வாய்ந்தவை, இது ஒரு புரட்சிகர அணு மாதிரிக்கு வழிவகுத்தது.
இந்த சோதனை பின்வருவனவற்றைக் கொண்டிருந்தது: 100nm தடிமன் கொண்ட ஒரு மெல்லிய தங்கத் தாள் ஒரு பெரிய அளவிலான ஆல்பா துகள்களுடன் குண்டு வீசப்பட வேண்டியிருந்தது. இந்த ஆல்பா துகள்கள் மற்றும் அயனிகள். அதாவது, எலக்ட்ரான்கள் இல்லாத அணுக்கள், எனவே அவற்றில் புரோட்டான்கள் மற்றும் நியூட்ரான்கள் மட்டுமே இருந்தன. நியூட்ரான்கள் மற்றும் புரோட்டான்கள் இருப்பதன் மூலம், அணுவின் மொத்த கட்டணம் நேர்மறையாக இருந்தது. இந்த சோதனை முக்கியமாக தாம்சன் மாதிரி சரியானதா என்பதை உறுதிப்படுத்தும் நோக்கத்தைக் கொண்டிருந்தது. இந்த மாதிரி சரியாக இருந்தால், ஆல்பா துகள்கள் தங்க அணுக்கள் வழியாக ஒரு நேர் கோட்டில் செல்ல வேண்டியிருந்தது.
ஆல்பா துகள்களால் ஏற்படும் விலகலைப் படிப்பதற்கு, ஒரு ஒளிரும் துத்தநாக சல்பைட் வடிகட்டி சிறந்த தங்கப் படலத்தைச் சுற்றி வைக்க வேண்டியிருந்தது. இந்த சோதனையின் விளைவாக, சில துகள்கள் தாளின் தங்க அணுக்கள் வழியாக ஒரு நேர் கோட்டில் செல்ல முடிந்தது என்பதைக் காண முடிந்தது. இருப்பினும், இந்த ஆல்பா துகள்கள் சில சீரற்ற திசைகளில் திசை திருப்பப்பட்டன.
தங்க இலை பரிசோதனையின் முடிவுகள்

இந்த உண்மையைப் பொறுத்தவரை, முந்தைய அணு மாதிரிகள் கருதப்படுவதை உறுதிப்படுத்த முடியவில்லை. இந்த அணு மாதிரிகள் அணுக்களில் நேர்மறைக் கட்டணம் ஒரே மாதிரியாக விநியோகிக்கப்படுவதாகவும், இது ஒரு குறிப்பிட்ட கட்டத்தில் அதன் கட்டணம் அவ்வளவு வலுவாக இருக்காது என்பதால் அதைக் கடக்க எளிதாக்கும் என்றும் சுட்டிக்காட்டியது.
இந்த தங்க இலை பரிசோதனையின் முடிவுகள் முற்றிலும் எதிர்பாராதவை. இது ரதர்ஃபோர்டுக்கு அணு ஒரு வலுவான நேர்மறை சார்ஜ் கொண்ட ஒரு மையத்தைக் கொண்டிருப்பதாக நினைத்தது, இது ஆல்பா துகள் செய்யும் போது செய்யப்பட்டது மத்திய கட்டமைப்பால் நிராகரிக்கப்பட்ட அதை அனுப்ப முயற்சிக்கவும். மிகவும் நம்பகமான மூலத்தை நிறுவுவதற்காக, துகள்கள் பிரதிபலிக்கப்பட்டவை மற்றும் இல்லாதவற்றின் அளவுகளில் கருதப்பட்டன. இந்த துகள்களின் தேர்வுக்கு நன்றி, அதைச் சுற்றியுள்ள எலக்ட்ரான்களின் சுற்றுப்பாதையுடன் ஒப்பிடும்போது கருவின் அளவை தீர்மானிக்க முடிந்தது. ஒரு அணுவின் பெரும்பாலான இடம் காலியாக உள்ளது என்றும் முடிவு செய்யலாம்.
அதைக் காணலாம், சில ஆல்பா துகள்கள் தங்கப் படலத்தால் திசை திருப்பப்பட்டன. அவற்றில் சில மிகச் சிறிய கோணங்களில் மட்டுமே விலகின. இது ஒரு அணுவின் நேர்மறை கட்டணம் சமமாக விநியோகிக்கப்படவில்லை என்ற முடிவுக்கு வர உதவியது. அதாவது, நேர்மறை கட்டணம் ஒரு அணுவில் ஒரு சிறிய அளவிலான இடத்தில் செறிவூட்டப்பட்ட வழியில் அமைந்துள்ளது.
மிகச் சில ஆல்பா துகள்கள் பின்னால் நகர்ந்தன. இந்த விலகல் பின்வருமாறு கூறியது துகள்கள் மீண்டும் எழுந்திருக்கக்கூடும். இந்த புதிய கருத்தாய்வுகளுக்கு நன்றி, ரதர்ஃபோர்டின் அணு மாதிரியை புதிய யோசனைகளுடன் நிறுவ முடியும்.
ரதர்ஃபோர்ட் அணு மாதிரி

ரதர்ஃபோர்டின் அணு மாதிரியின் கொள்கைகள் என்ன என்பதை நாங்கள் படிக்கப் போகிறோம்:
- ஒரு அணுவுக்குள் நேர்மறை கட்டணம் கொண்ட துகள்கள் சொன்ன அணுவின் மொத்த அளவோடு ஒப்பிட்டுப் பார்த்தால் அவை மிகச் சிறிய அளவில் அமைக்கப்பட்டிருக்கும்.
- ஒரு அணுவின் கிட்டத்தட்ட அனைத்து வெகுஜனங்களும் குறிப்பிடப்பட்ட சிறிய தொகுதியில் உள்ளன. இந்த உள் நிறை கரு என்று அழைக்கப்பட்டது.
- எதிர்மறை கட்டணங்களைக் கொண்ட எலக்ட்ரான்கள் கருவைச் சுற்றி சுழலும்.
- எலக்ட்ரான்கள் கருவைச் சுற்றி இருக்கும்போது அதிக வேகத்தில் சுழல்கின்றன, அவை வட்ட பாதைகளில் அவ்வாறு செய்கின்றன. இந்த பாதைகள் சுற்றுப்பாதைகள் என்று அழைக்கப்பட்டன. பின்னர் செய்வேன் அவை சுற்றுப்பாதைகள் என்று அழைக்கப்படுகின்றன.
- எதிர்மறையாக சார்ஜ் செய்யப்பட்ட அந்த எலக்ட்ரான்கள் மற்றும் நேர்மறையாக சார்ஜ் செய்யப்பட்ட அணுவின் கரு ஆகியவை எப்போதும் மின்னியல் கவர்ச்சிகரமான சக்திக்கு நன்றி செலுத்துகின்றன.
ரதர்ஃபோர்டின் அணு மாதிரியின் ஏற்றுக்கொள்ளல் மற்றும் வரம்புகள்
எதிர்பார்த்தபடி, இந்த புதிய மாதிரி விஞ்ஞான உலகில் அணுவின் முழு புதிய பனோரமாவையும் கற்பனை செய்தது. இந்த அணு மாதிரிக்கு நன்றி, பல பிற்கால விஞ்ஞானிகள் கால அட்டவணையில் உள்ள ஒவ்வொரு உறுப்புக்கும் எலக்ட்ரான்களின் எண்ணிக்கையை படித்து தீர்மானிக்க முடியும். கூடுதலாக, புதிய கண்டுபிடிப்புகள் ஒரு அணுவின் செயல்பாட்டை எளிமையான முறையில் விளக்க உதவும்.
இருப்பினும், இந்த மாதிரியில் சில வரம்புகள் மற்றும் பிழைகள் உள்ளன. இது இயற்பியல் உலகில் ஒரு திருப்புமுனை என்றாலும், அவை சரியானவை அல்லது முழுமையான மாதிரி அல்ல. மற்றும் அது நியூட்டனின் சட்டங்களின்படி மற்றும் மேக்ஸ்வெல்லின் சட்டங்களின் முக்கிய அம்சத்தின் படி, இந்த மாதிரியால் சில விஷயங்களை விளக்க முடியவில்லை:
- எதிர்மறை கட்டணங்கள் எவ்வாறு கருவில் ஒன்றாகப் பிடிக்க முடிந்தது என்பதை அவரால் விளக்க முடியவில்லை. எலக்ட்ரானிக் திபியாவின் கூற்றுப்படி, நேர்மறை கட்டணங்கள் ஒருவருக்கொருவர் விரட்ட வேண்டும்.
- மற்றொரு முரண்பாடு மின்னாற்பகுப்பின் அடிப்படை விதிகளுக்கு எதிராக இருந்தது. நேர்மறை கட்டணம் கொண்ட எலக்ட்ரான்கள் கருவைச் சுற்றுவதாகக் கருதப்பட்டால், அவை மின்காந்த கதிர்வீச்சை வெளியிட வேண்டும். இந்த கதிர்வீச்சை வெளியிடும் போது, எலக்ட்ரான்கள் கருவில் சரிவதற்கு ஆற்றல் நுகரப்படுகிறது. எனவே, அணைக்கப்பட்ட அணு மாதிரியால் அணுவின் ஸ்திரத்தன்மையை விளக்க முடியாது.
இந்த தகவலுடன் நீங்கள் ரதர்ஃபோர்டின் அணு மாதிரியைப் பற்றி மேலும் அறியலாம் என்று நம்புகிறேன்.