
Inom vetenskapen har det varit många forskare som har gjort skillnad när det gäller att veta hur saker och ting fungerar. Kunskap om partiklar, atomer och elektroner har gett många framsteg inom vetenskapen. Därför kommer vi att ägna den här artikeln till Thomsons atommodell. Det var också känt som Raisin Pudding-modellen.
I den här artikeln kan du lära dig allt relaterat till Thomsons atommodell, vad dess egenskaper är och hur viktigt det var för vetenskapen.
Vad är Thomsons atommodell

Detta är en modell som utvecklades 1904 och den första subatomära partikeln kan ha upptäckts. Upptäckaren var den brittiska forskaren Joseph John Thomson. Den här mannen kunde upptäcka negativt laddade partiklar genom ett experiment där han använde katodstrålerör 1897.
Konsekvensen av denna upptäckt var ganska enorm eftersom det inte fanns några bevis för att atomen kunde ha en kärna. Denna vetenskapsman får oss att tro att elektronerna nedsänktes i ett slags positivt laddat ämne som motverkar elektronernas negativa laddning. Det var detta som fick atomerna att ha den neutrala laddningen.
Att förklara dem på ett sätt som förstås är som att placera en gelé med russin som flyter inuti. Därav modellnamnet pudding med russin. I den här modellen, Thomson var ansvarig för att kalla elektronerna kroppar och ansåg att de var ordnade på ett icke-slumpmässigt sätt. Idag är det känt att de finns i ett slags roterande ringar och att varje ring har olika energinivå. När en elektron tappar energi går den till en högre nivå, det vill säga den rör sig bort från atomens kärna.
Guldfoliexperiment

Vad Thompson tyckte var att den positiva delen av atomen alltid förblev på obestämd tid. Denna modell som han skapade 1904 hade inte utbredd akademisk acceptans. Fem år senare kunde Geiger och Marsden utföra ett experiment med en guldfolie som gjorde Thomsons upptäckter mindre effektiva. I detta experiment passerade de en stråle av helium alfapartiklar genom en guldfolie. Alfapartiklar är inget annat än lejon av ett element, det vill säga kärnor som inte har elektroner och därför har en positiv laddning.
Resultatet av experimentet var att denna stråle sprids när den passerade genom guldfolien. Med detta kunde man dra slutsatsen att det måste finnas en kärna med en källa med positiv laddning som var ansvarig för att avböja ljusstrålen. Å andra sidan hade vi i Thomsons atommodell att den positiva laddningen fördelades längs det som sades som gelatin och som innehöll elektronerna. Detta innebär att en stråle av joner kan passera genom atomen i den modellen.
När det motsatta visades i det efterföljande experimentet, denna modell kan förnekas atom.
Upptäckten av elektronen kom också från en del av en annan atommodell men från Dalton. I den modellen ansågs atomen vara helt odelbar. Det är detta som fick Thomson att tänka på sin Raisin Pudding-modell.
Kännetecken för Thomsons atommodell
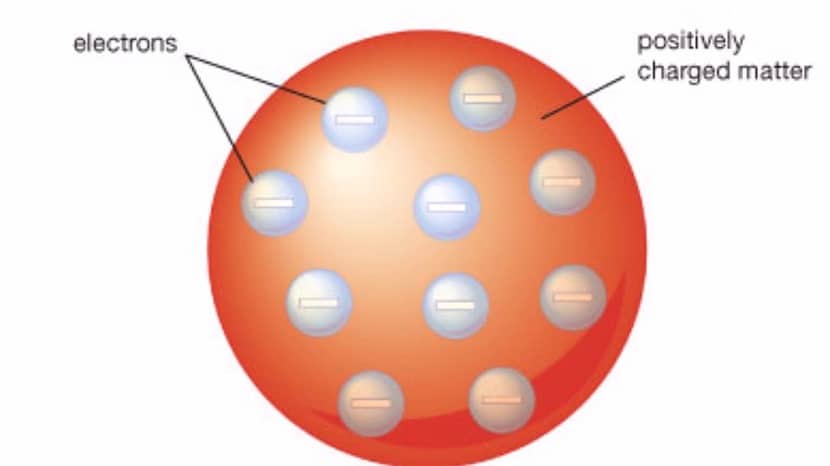
Bland de viktigaste egenskaperna hos denna modell sammanfattar vi följande:
- Atomen som denna modell representerar liknar en sfär som har ett positivt laddat material med elektroner som är negativt laddade. Både elektroner och positivt laddade ämnen finns inne i sfären.
- De positiva och negativa laddningarna har samma storlek. Detta innebär att atomen som helhet inte har någon laddning utan är elektriskt neutral.
- Så att atomen i allmänhet kan ha en neutral laddning elektronerna behöver nedsänkas i ett ämne som har en positiv laddning. Det är det som nämns med russin som en del av elektronerna och resten av gelatinet är den del med en positiv laddning.
- Även om det inte förklaras på ett uttryckligt sätt kan man dra slutsatsen att atomkärnan inte fanns i denna modell.
När Thomson skapade denna modell övergav han den tidigare hypotesen om nebulära atomen. Denna hypotes baserades på det faktum att atomer bestod av immateriella virvlar. Som en skicklig forskare ville han skapa sin egen atommodell baserat på de experimentella bevis som var kända på hans tid.
Trots att den här modellen inte var helt korrekt kunde den hjälpa till med att skapa en fast grund så att senare modeller kunde bli mer framgångsrika. Tack vare denna modell var det möjligt att genomföra olika experiment som ledde till nya slutsatser och det är hur den vetenskap som vi känner idag utvecklades mer och mer.
Begränsningar och fel i Thomsons atommodell
Vi kommer att analysera vilka frågor där modellen inte lyckades och varför den inte kunde fortsätta. Det första är att han inte kunde förklara hur laddningarna hålls på elektronerna inuti atomen. Genom att inte kunna förklara detta kunde han inte heller lösa något om en atoms stabilitet.
I sin teori nämnde han ingenting om atomen som hade en kärna. Hade vi idag vet att atomen består av kärnan består av protoner och neutroner och elektroner roterar runt på olika energinivåer.
Protoner och neutroner skulle ännu inte upptäckas. Thompson försökte basera sin modell på en förklaring med de element som vetenskapligt bevisats vid den tiden. När guldfolieexperimentet verifierades kastades det snabbt bort. I detta experiment visades att det måste finnas något inuti atomen som skulle få den att ha en positiv laddning och en större massa. Detta är redan känt för att vara atomens kärna.
Jag hoppas att du med den här informationen kan lära dig mer om Thomsons atommodell.