
La Prawo Boyle'a została odkryta przez Roberta Boyle'a w XVII wieku i położyła podwaliny pod wyjaśnienie związku między ciśnieniem a objętością obecną w gazach. Poprzez serię eksperymentów udało mu się wykazać, że jeśli temperatura jest stała, gaz zmniejsza swoją objętość, gdy jest poddawany większemu ciśnieniu, i zwiększa swoją objętość, gdy ciśnienie jest zmniejszone.
W tym artykule powiemy Ci wszystko, co musisz wiedzieć o prawie Boyle'a, jego cechach i znaczeniu.
Główne cechy
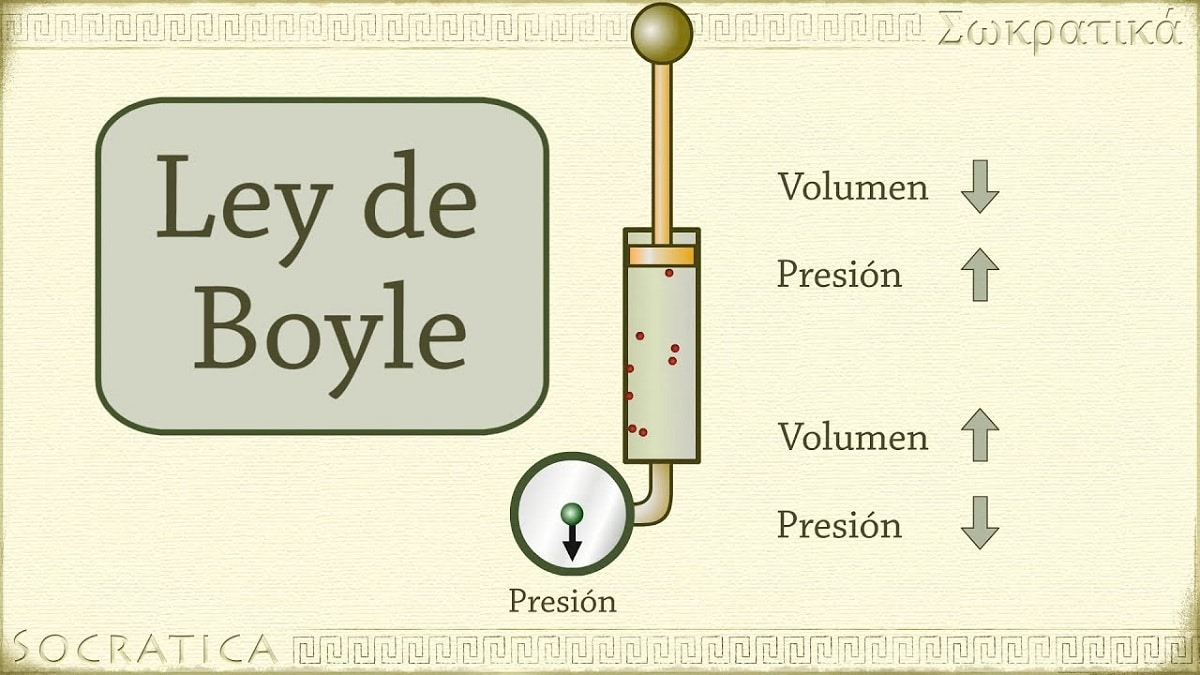
W 1662 Robert Boyle odkrył, że ciśnienie wywierane na gaz jest odwrotnie proporcjonalne do jego objętości i liczby moli w stałej temperaturze. Innymi słowy, jeśli ciśnienie przyłożone do gazu zostanie podwojone, ten sam gaz zostanie sprężony, a jego objętość zmniejszona o połowę.
Wraz ze wzrostem objętości pojemnika zawierającego gaz zwiększa się również odległość, jaką muszą pokonać cząstki, zanim zderzą się ze ścianami pojemnika. Ten wzrost odległości pozwala na zmniejszenie częstotliwości wstrząsów, więc nacisk na ścianę jest mniejszy niż wcześniej, gdy objętość była mniejsza.
Prawo Boyle'a zostało po raz pierwszy odkryte w 1662 roku przez Roberta Boyle'a. Edme Mariotte był kolejnym naukowcem, który myślał i doszedł do tych samych wniosków co Boyle, jednak Mariotte nie upublicznił swojej pracy dopiero w 1676 roku. Dlatego w wielu książkach znajdujemy to prawo zwane Boyle and Mariot's Law Boyle-Mariot's Law, znane również jako Mattut's Law, opracowane przez brytyjskiego fizyka i chemika Roberta. niezależnie Boyle i francuski fizyk i botanik Edmé Mattout.
Odnosi się do jednego z praw, które wiążą objętość i ciśnienie gazu z określoną ilością gazu utrzymywaną w stałej temperaturze. Prawo Boyle'a mówi, co następuje: Ciśnienie wywierane przez siłę jest fizycznie odwrotnie proporcjonalne do objętości materii gazowej, o ile jej temperatura pozostaje stała. Lub prościej, możemy to zinterpretować jako: przy wyższej stałej temperaturze objętość stałej masy gazu jest odwrotnie proporcjonalna do stałego ciśnienia, jakie wywiera.
Eksperymenty i zastosowania prawa Boyle'a

Aby udowodnić teorię prawa Boyle'a, Mariot był odpowiedzialny za wprowadzanie gazu do cylindra z tłokiem i był w stanie zweryfikować różne ciśnienia, które powstawały podczas opadania tłoka. Z tego doświadczenia wywnioskowano, że wraz ze wzrostem objętości ciśnienie spada.
Prawo Boyle'a ma wiele zastosowań we współczesnym życiu, wśród których możemy wymienić na przykład nurkowanie, ponieważ nurek podczas wynurzania musi wyrzucić powietrze z płuc, ponieważ rozszerza się ono, gdy ciśnienie spada, a jeśli nie, może to spowodować uszkodzenie tkanek.
Występuje we wszystkich urządzeniach, które wykorzystują lub są zasilane przez energię pneumatyczną, takich jak ramiona robotów, które wykorzystują elementy, takie jak tłoki pneumatyczne, siłowniki, regulatory ciśnienia i zawory nadmiarowe ciśnienia.
Silniki benzynowe, gazowe lub wysokoprężne również wykorzystują prawo Boyle'a podczas spalania wewnętrznego, ponieważ za pierwszym razem powietrze wchodzi do cylindra z objętością i ciśnieniem, za drugim razem zmniejsza objętość poprzez zwiększenie ciśnienia.
Samochody wyposażone są w systemy poduszek powietrznych, które wyrzucają pewną ilość powietrza lub gazu z komory, która dociera do zewnętrznej poduszki powietrznej, gdzie ciśnienie spada, a objętość wzrasta, utrzymując stałą temperaturę.
Prawo Boyle'a jest dziś bardzo ważne, ponieważ to właśnie ono do nas przemawia i wyjaśnia zachowanie gazów. To zdecydowanie wyjaśnia, że ciśnienie i objętość gazu są do siebie odwrotnie proporcjonalne. Dlatego też, gdy do gazu przykładane jest ciśnienie, jego objętość maleje, a ciśnienie wzrasta.
idealny model gazu

Prawo Boyle'a-Mariotte'a ma zastosowanie do tzw. gazów doskonałych, modelu teoretycznego, który znacznie upraszcza zachowanie dowolnego gazu, zakładając:
- cząsteczki gazu są tak małe, że nie trzeba myśleć o ich wielkości, zwłaszcza biorąc pod uwagę, że jest to znacznie mniej niż odległość, którą pokonują.
- Ponadto, cząsteczki ledwo oddziałują, chyba że zderzają się bardzo krótko, a kiedy zderzają się, zderzenie jest elastyczne, więc zarówno pęd, jak i energia kinetyczna są zachowane.
- Na koniec załóżmy, że ta energia kinetyczna jest proporcjonalna do temperatury próbki gazowej, to znaczy im bardziej wzburzone cząstki, tym wyższa temperatura.
Gazy lekkie, niezależnie od ich tożsamości, bardzo ściśle przestrzegają tych wytycznych w standardowych warunkach temperatury i ciśnienia (tj. 0ºC i ciśnienia atmosferycznego (1 atmosfera). Dla tych gazów prawo Boyle'a-Mariotte'a bardzo dokładnie opisuje ich zachowanie.
Ponieważ P∙V jest stałe w danej temperaturze, jeśli ciśnienie gazu zmienia się, zmienia się objętość, tak że produkt pozostaje taki sam, więc w dwóch różnych stanach 1 i 2 równość można wyrazić następująco:
P1∙V1 = P2∙V2
Znając jeden stan oraz zmienną z drugiego stanu, możesz poznać brakującą zmienną, usuwając ją z prawa Boyle-Mariota.
Historia prawa Boyle'a
Brytyjski chemik. Pionier eksperymentów w dziedzinie chemii, zwłaszcza we właściwościach gazów,
Teza Roberta Boyle'a o zachowaniu materii na poziomie cząstek była prekursorem współczesnej teorii pierwiastków chemicznych. Był także członkiem założycielem Royal Society of London.
Robert Boyle urodził się w szlacheckiej rodzinie w Irlandii i uczęszczał do najlepszych angielskich i europejskich szkół. Od 1656 do 1668 był asystentem Roberta Hooke'a na Uniwersytecie Oksfordzkim, współpracując z nim przy serii eksperymentów, które określały fizyczne właściwości powietrza oraz sposób jego spalania, oddychania i przenoszenia dźwięku.
Wyniki tych składek zostały zebrane w ich «Nowe eksperymenty fizyko-mechaniczne dotyczące elastyczności powietrza i jego skutków» (1660). W drugim wydaniu tej pracy (1662) ujawnił słynną właściwość gazów, prawo Boyle-Mariotte, które stwierdzało, że objętość zajmowana przez gaz o stałej temperaturze jest odwrotnie proporcjonalna do jego ciśnienia. Dziś wiadomo, że prawo to jest spełnione tylko wtedy, gdy zaakceptuje się teoretyczne idealne zachowanie gazów.
Mam nadzieję, że dzięki tym informacjom można dowiedzieć się więcej o prawie Boyle'a, jego charakterystyce i zastosowaniach w świecie nauki.