
Nach der Bekanntschaft Thomsons Atommodell, die Elektronen als in einem positiv geladenen Medium befindlich betrachteten, ein fortgeschritteneres Modell, bekannt als Rutherford-Atommodell. Der Wissenschaftler, der für diesen neuen Fortschritt für die Wissenschaft verantwortlich war, war Ernest Rutherford. Er wurde am 20. August 1871 geboren und starb am 19. Oktober 1937. Während seines Lebens leistete er große Beiträge zur Chemie und zur Welt der Wissenschaft im Allgemeinen.
Aus diesem Grund widmen wir Ihnen in diesem Artikel alles, was Sie über das Atommodell von Rutherford wissen müssen.
Blattgold-Experiment
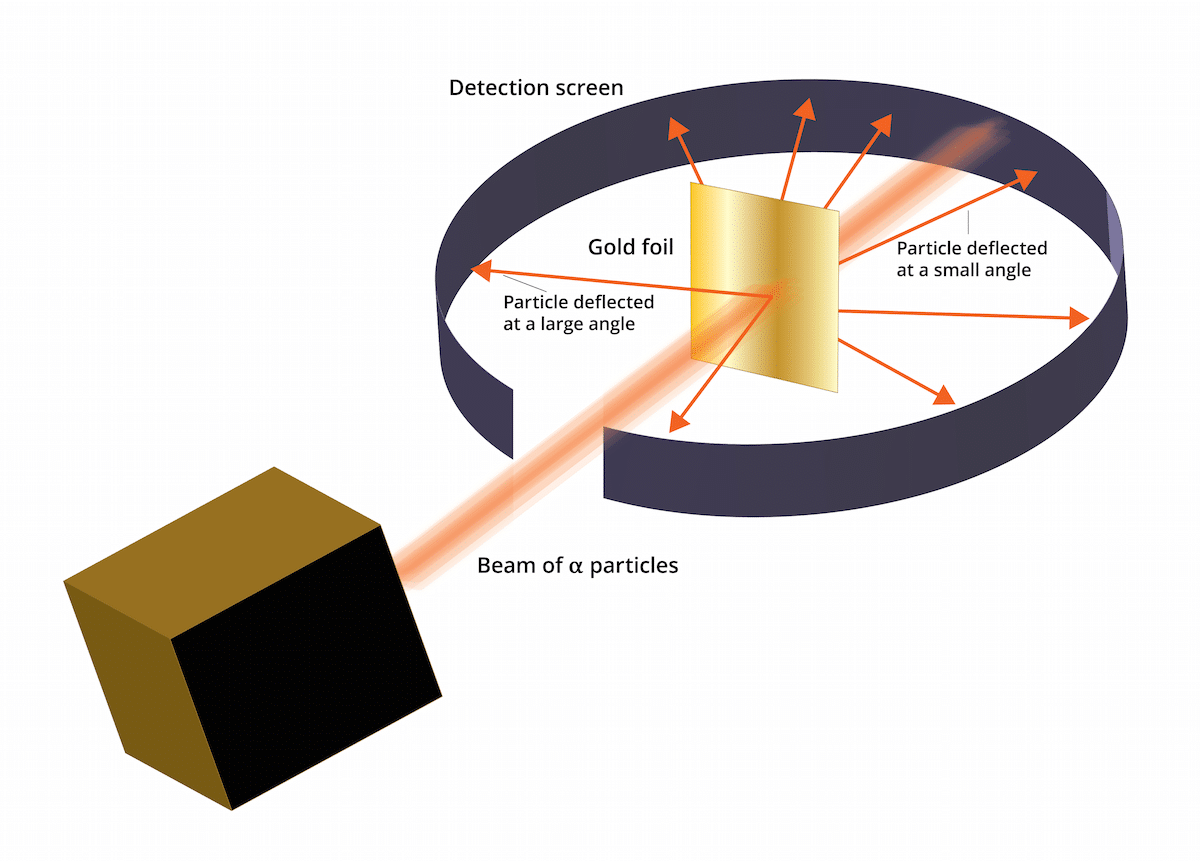
Das alte Thomson-Modell sagte, dass sich die Elektronen in einem positiv geladenen Medium befanden. 1909 führte Ernest Rutherford in Begleitung von zwei Assistenten namens Geiger und Marsden eine als Gold Leaf-Experiment bekannte Studie durch, in der sie dies überprüfen konnten Thomsons bekannter "Rosinenpudding" war falsch. Und dieses neue Experiment konnte zeigen, dass das Atom eine Struktur mit einer starken positiven Ladung hatte. Dieses Experiment oder könnte dazu beitragen, einige Schlussfolgerungen wiederherzustellen, die 1911 als Rutherfords Atommodell präsentiert wurden.
Das als Blattgold bekannte Experiment war nicht einzigartig, wurde jedoch zwischen 1909 und 1913 durchgeführt. Dafür verwendeten sie die Physiklabors der Universität von Manchester. Diese Experimente waren von großer Bedeutung, da aus ihren Ergebnissen neue Schlussfolgerungen gezogen werden konnten, die zu einem revolutionären Atommodell führten.
Dieses Experiment bestand aus Folgendem: Ein dünnes, nur 100 nm dickes Goldblech musste mit einer großen Menge Alpha-Teilchen beschossen werden. Diese Alpha-Teilchen waren und Ionen. Das heißt, Atome, die keine Elektronen haben, also nur Protonen und Neutronen. Durch Neutronen und Protonen war die Gesamtladung des Atoms positiv. Dieses Experiment hatte hauptsächlich das Ziel zu bestätigen, ob das Thomson-Modell korrekt war. Wenn dieses Modell richtig war, Die Alpha-Teilchen mussten in einer geraden Linie durch die Goldatome gehen.
Um die durch Alpha-Partikel verursachte Durchbiegung zu untersuchen, musste ein fluoreszierender Zinksulfidfilter um die feine Goldfolie gelegt werden. Das Ergebnis dieses Experiments ist, dass beobachtet wurde, dass einige Partikel in der Lage waren, die Goldatome der Folie in einer geraden Linie zu passieren. Einige dieser Alpha-Partikel wurden jedoch in zufällige Richtungen abgelenkt.
Schlussfolgerungen des Blattgoldversuchs

Angesichts dieser Tatsache war es nicht möglich zu bestätigen, was die vorherigen Atommodelle berücksichtigen. Und es ist so, dass diese Atommodelle darauf hinwiesen, dass die positive Ladung gleichmäßig in den Atomen verteilt war und dies das Überqueren erleichtern würde, da ihre Ladung an einem bestimmten Punkt nicht so stark wäre.
Die Ergebnisse dieses Blattgold-Experiments waren völlig unerwartet. Dies ließ Rutherford denken, dass das Atom ein Zentrum mit einer starken positiven Ladung hatte, die bei einem Alpha-Teilchen entstand versuchen Sie es von der zentralen Struktur abgelehnt weiterzugeben. Um eine zuverlässigere Quelle zu etablieren, wurden die Partikel in Mengen von denen berücksichtigt, die reflektiert wurden und von denen, die nicht reflektiert wurden. Dank dieser Auswahl von Teilchen war es möglich, die Größe des Kerns im Vergleich zur Umlaufbahn der Elektronen zu bestimmen, die sich um ihn herum befinden. Es könnte auch geschlossen werden, dass der größte Teil des Raums eines Atoms leer ist.
Es war zu sehen, dass einige Alpha-Partikel von der Goldfolie abgelenkt wurden. Einige von ihnen weichen nur in sehr kleinen Winkeln ab. Dies führte zu dem Schluss, dass die positive Ladung eines Atoms nicht gleichmäßig verteilt ist. Das heißt, die positive Ladung befindet sich konzentriert auf einem Atom in einem sehr kleinen Raumvolumen.
Sehr wenige Alpha-Partikel trieben zurück. Diese Abweichung zeigt wie folgt an, dass die Partikel zurückprallen könnten. Dank all dieser neuen Überlegungen konnte Rutherfords Atommodell mit neuen Ideen etabliert werden.
Rutherfords Atommodell

Wir werden untersuchen, was die Prinzipien von Rutherfords Atommodell sind:
- Teilchen, die innerhalb eines Atoms eine positive Ladung haben Sie sind in einem sehr kleinen Volumen angeordnet, wenn wir es mit dem Gesamtvolumen des Atoms vergleichen.
- Fast die gesamte Masse eines Atoms befindet sich in dem genannten kleinen Volumen. Diese innere Masse wurde als Kern bezeichnet.
- Elektronen mit negativen Ladungen Sie drehen sich um den Kern.
- Die Elektronen drehen sich mit hoher Geschwindigkeit, wenn sie sich um den Kern befinden, und dies auf Kreisbahnen. Diese Flugbahnen wurden Umlaufbahnen genannt. Später werde ich Sie sind als Orbitale bekannt.
- Sowohl die negativ geladenen Elektronen als auch der Kern des positiv geladenen Atoms selbst werden dank der elektrostatischen Anziehungskraft immer zusammengehalten.
Akzeptanz und Einschränkungen von Rutherfords Atommodell
Wie erwartet sah dieses neue Modell ein völlig neues Panorama des Atoms in der wissenschaftlichen Welt vor. Dank dieses Atommodells konnten viele spätere Wissenschaftler die Anzahl der Elektronen untersuchen und bestimmen, die jedes Element im Periodensystem hat. Darüber hinaus könnten neue Entdeckungen gemacht werden, die helfen, die Funktionsweise eines Atoms auf einfachste Weise zu erklären.
Dieses Modell weist jedoch auch einige Einschränkungen und Fehler auf. Obwohl es ein Durchbruch in der Welt der Physik war, waren sie weder ein perfektes noch ein vollständiges Modell. Und ist das von nach Newtons Gesetzen und einem wichtigen Aspekt von Maxwells Gesetzen, Dieses Modell konnte bestimmte Dinge nicht erklären:
- Er konnte nicht erklären, wie negative Ladungen im Kern zusammenhalten konnten. Positive Ladungen müssen sich laut elektronischer Tibia gegenseitig abstoßen.
- Ein weiterer Widerspruch betraf die Grundgesetze der Elektrodynamik. Wenn davon ausgegangen werden soll, dass sich Elektronen mit einer positiven Ladung um den Kern drehen, sollten sie elektromagnetische Strahlung emittieren. Bei der Emission dieser Strahlung wird Energie verbraucht, damit die Elektronen im Kern kollabieren. Daher kann das gestreifte Atommodell die Stabilität des Atoms nicht erklären.
Ich hoffe, dass Sie mit diesen Informationen mehr über Rutherfords Atommodell erfahren können.