在物理學世界中,有一個分支機構負責研究系統中熱量和功產生的轉換。 這是關於 熱力學。 它是物理學的一個分支,負責研究所有僅在宏觀水平上涉及溫度和能量的狀態變量變化的過程的轉換。
在本文中,我們將告訴您有關熱力學和熱力學原理的所有知識。
Característicasprincipales
如果我們對經典的熱力學進行分析,我們會發現它是基於宏觀系統的概念。 該系統不過是與外部環境分離的一部分物理或概念質量。 為了更好地研究熱力學系統,始終假定其是不受與外部生態系統交換能量干擾的物理物質。
宏觀系統的狀態是什麼 在平衡條件下,它由稱為熱力學變量的量指定。 我們知道所有這些變量,它們是溫度,壓力,體積和化學成分。 所有這些變量定義了系統及其平衡。 由於應用的國際聯盟,化學熱力學中的主要符號已經建立。 使用這些單元,可以工作並更好地解釋熱力學定律。
但是,有一個熱力學分支不研究平衡,而是負責分析熱力學過程,其主要特徵是 沒有能力以穩定的方式達到平衡條件。
法規
這些原則在XNUMX世紀被Isa譴責, 他們負責調節所有變革及其進展。 他們還分析了什麼才是真正的限制。 它們是無法被證明但根據經驗無法被證明的公理。 每個熱力學理論都基於這些原理。 我們可以區分3個基本原理和原理,但這是定義溫度的原理,並且在其他3個原理中是隱含的。
零法則
我們將描述零定律是什麼,這是第一個描述其餘原理中隱含的溫度的函數。 當兩個系統相互影響並處於熱平衡狀態時,它們將共享一些特性。 它們彼此共享的這些特性可以被測量並給出數值。 結果,如果兩個系統與第三個系統處於平衡狀態,則它們將彼此處於平衡狀態,並且共有的屬性是溫度。
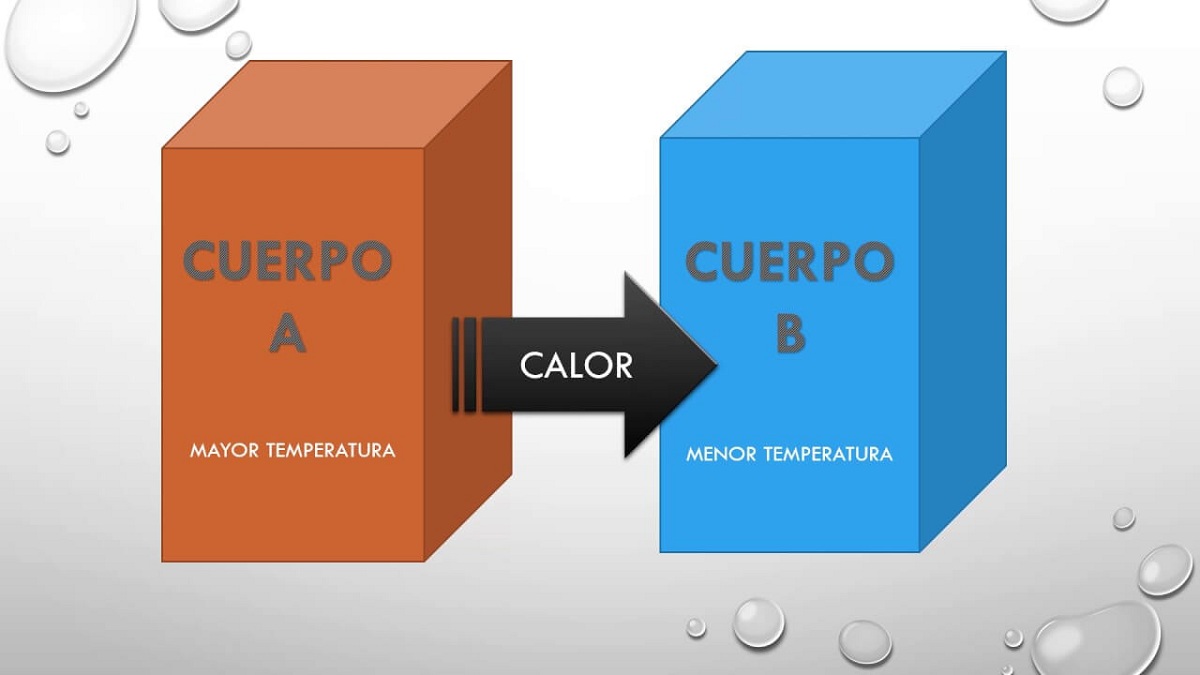
因此,這個原則只是簡單說明 物體A與物體B處於平衡狀態,並且該物體B與物體C處於熱平衡狀態,那麼物體A和C也將處於平衡狀態 熱的。 該原理解釋了以下事實:處於不同溫度的兩個物體可以相互交換熱量。 兩個物體遲早會達到相同的溫度,因此它們處於完全平衡狀態。
熱力學第一定律
當物體與較冷的物體接觸時,會發生轉變,從而導致平衡狀態。 這種平衡狀態基於以下事實:兩個物體的溫度相等,因為在冷物體的熱物體之間能量傳遞得以增強。 為了解釋這種現象,科學家們假設存在的熱物質越多越冷。 人們想到一種可以在團塊中移動以交換熱量的流體。
該原理負責將熱量識別為一種能量形式。 它不是物質。 以這種方式,可以表明以卡路里為單位的熱量和以焦耳為單位的熱量是等效的。 因此,我們今天知道 1卡路里約為4,186焦耳。
可以說,熱力學的第一原理是能量守恆的原理。 熱機中的一定量的能量被轉換為功,並且任何可以在不消耗能量的情況下進行這種功的機器都可以看到。 我們可以建立該第一原理為:封閉的熱力學系統的內部能量的變化等於提供給系統的熱量與該系統在環境中完成的功之間存在的差。
熱力學第二定律
在一開始,這說明不可能製造出僅導致熱量從冷體傳遞到熱體的周期性機器。 我們可以說不可能進行轉換,而轉換的結果只會是 將我們從單一來源獲取的熱量轉換為機械功。
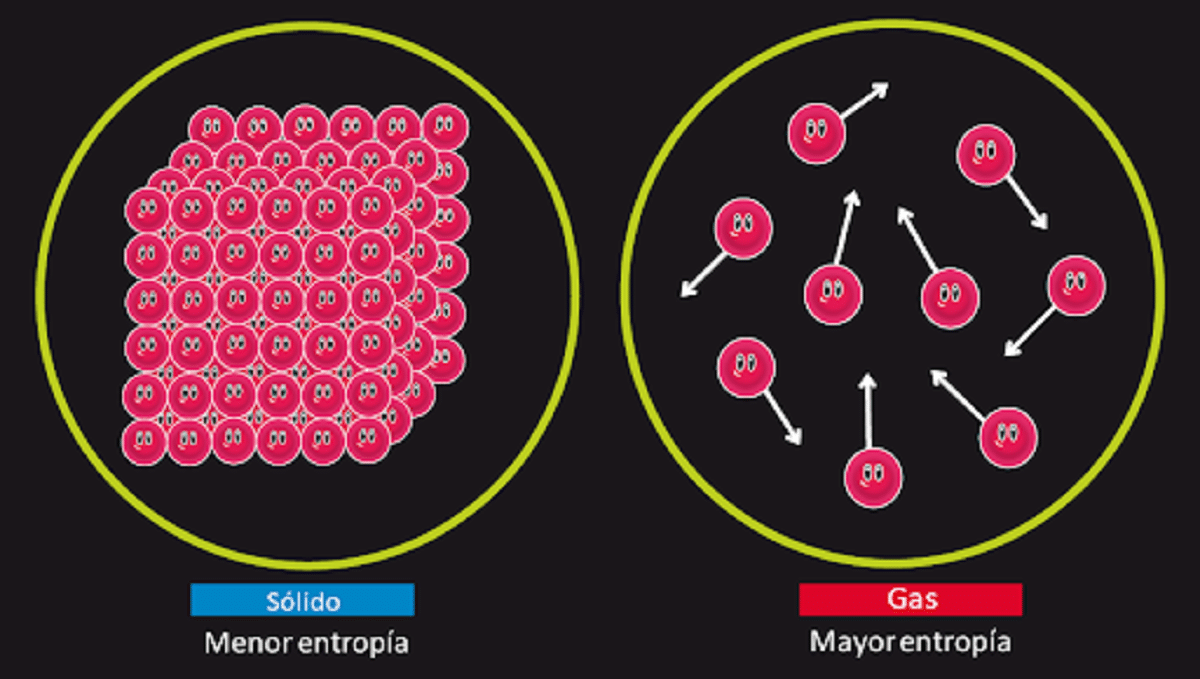
該原理負責否認存在第二種恆久運動的可能性。 我們知道 熵 當發生可逆轉換時,系統的隔離狀態保持不變。 我們還知道,當發生不可逆轉換時,它會增加。
熱力學第三定律
最後一個原則與第二個原則密切相關,因此被認為是第二個原則的結果。 該原理肯定了通過有限數量的變換無法在顏色上實現絕對存在。 我們知道絕對零不超過可以達到的最低溫度。 單位 開爾文我們知道它是0,但是以攝氏度為單位,它的值為-273.15度。
它還指出,對於溫度為0開爾文的完全結晶的固體,其熵等於0。這意味著將沒有熵,因此系統將完全穩定。 在0開爾文溫度下,組成它的粒子的釋放,平移和旋轉的能量將為零。
我希望藉助這些信息,您可以了解有關熱力學和基本原理的更多信息。