
Ви коли-небудь бачили Атомна модель Бора. Це досить важливе відкриття, яке цей вчений зробив для науки, особливо електромагнетизму та електрохімії. Раніше була модель Резерфорда, яка була досить революційною і дуже успішною, але існували деякі конфлікти з іншими атомними законами, такими як Максвелл і Ньютон.
У цій статті ми розповімо вам все, що вам потрібно знати про атомну модель Бора, а також її подробиці, щоб з’ясувати будь-які сумніви з цього приводу.
Проблеми, які це допомогло вирішити
Як ми вже згадували на початку статті, ця атомна модель допомогла вирішити певні конфлікти, що існували з іншими атомними законами. У попередній моделі Резерфорда нам довелося електрони, що рухаються з негативним електричним зарядом, повинні були випромінювати тип електромагнітного випромінювання. Це повинно бути виконано завдяки законам електромагнетизму, що існують там. Ця втрата енергії призводить до того, що електрони зменшуються до своєї орбіти, спираючись до центру. Коли вони дійшли до центру, вони зруйнувались, зіткнувшись із серцевиною.
Це створило теоретичну проблему, оскільки вона не могла руйнуватися з ядром атомів, але траєкторія руху електронів повинна бути іншою. Це було вирішено за допомогою атомної моделі Бора. Це пояснює це електрони обертаються навколо ядра на певних дозволених орбітах, що мають певну енергію. Енергія пропорційна константі Планка.
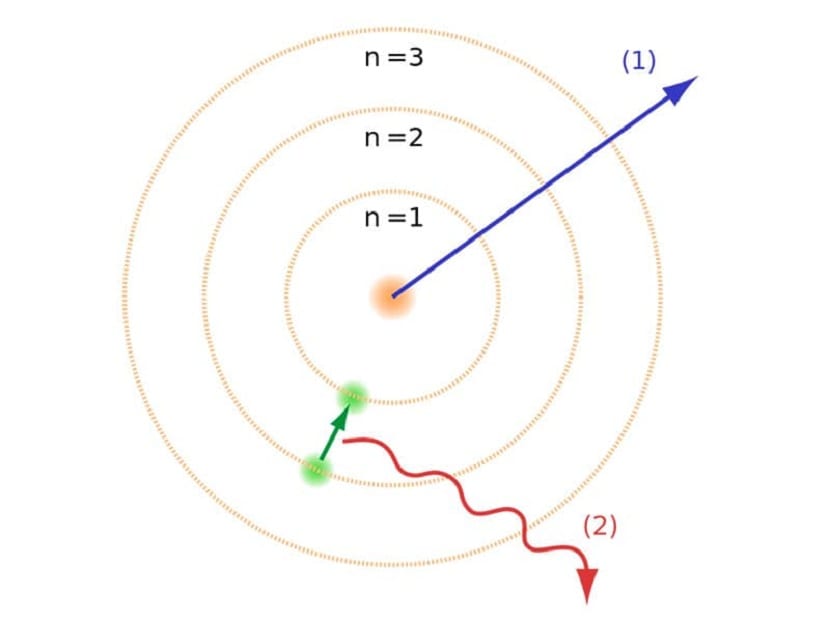
Ці орбіти, про які ми вже згадували, куди рухаються електрони, називались енергетичними шарами або енергетичними рівнями. Тобто енергія, яку мають електрони, не однакова завжди, але квантована. Квантові рівні - це різні орбіти, на яких знаходяться атоми. Залежно від того, на якій орбіті він знаходиться в будь-який момент, він матиме більшу або меншу енергію. Орбіти, розташовані ближче до ядра атома, мають більшу кількість енергії. З іншого боку, чим більше вони віддаляються від ядра, тим менше енергії.
Модель рівня енергії
Ця атомна модель Бора, яка передбачала, що електрони могли отримувати або втрачати енергію, лише перестрибуючи з однієї орбіти на іншу, допомогла вирішити крах, запропонований моделлю Резерфорда. При переході від одного енергетичного рівня до іншого він поглинає або випромінює електромагнітне випромінювання. Тобто, коли ви перескакуєте від більш зарядженого рівня енергії до менш зарядженого, ви звільняєте надлишок енергії. І навпаки, коли він переходить від низького рівня енергії до більш високого, він поглинає електромагнітне випромінювання.
Оскільки ця атомна модель є модифікацією моделі Резерфорда, характеристики малого центрального ядра та більшої частини маси атома зберігаються. Хоча орбіти електронів не рівні, як у планет, можна сказати, що ці електрони обертаються навколо свого ядра подібно до планет навколо Сонця.
Принципи атомної моделі Бора

Зараз ми проаналізуємо принципи цієї атомної моделі. Йдеться про детальне пояснення згаданої моделі та її функціонування.
- Частинки, що мають позитивний заряд Вони мають низьку концентрацію порівняно із загальним об’ємом атома.
- Електрони з негативним електричним зарядом - це ті, які обертаються навколо ядра на кругових орбітах енергії.
- Існують енергетичні рівні орбіт, по яких циркулюють електрони. Вони також мають заданий розмір, тому між орбітами немає проміжного стану. Вони просто переходять з одного рівня на інший.
- Енергія, якою володіє кожна орбіта, пов’язана з її розміром. Чим далі орбіта знаходиться від ядра атома, тим більше енергії вона має.
- Енергетичні рівні мають різну кількість електронів. Чим нижчий рівень енергії, тим менше електронів він містить. Наприклад, якщо ми знаходимось на рівні один, то буде до двох електронів. На рівні 2 може бути до 8 електронів, тощо.
- Коли електрони рухаються з однієї орбіти на іншу, вони поглинають або вивільняють електромагнітну енергію. Якщо ви переходите з одного енергетичного рівня на інший менше, ви звільняєте надлишок енергії і навпаки.
Ця модель була революційною і намагалася надати стабільності матеріалу, якого не було в попередніх моделях. Дискретні спектри випромінювання та поглинання газів також були пояснені за допомогою цієї атомної моделі. Це була перша модель, яка запровадила поняття квантування або квантування. Це робить атомну модель Бора моделлю, яка знаходиться на півдорозі між класичною механікою та квантовою механікою. Хоча він також має недоліки, він був моделлю-попередником для пізнішої квантової механіки Шредінгера та інших вчених.
Обмеження та помилки атомної моделі Бора
Як ми вже згадували, ця модель також має певні недоліки та помилки. Перш за все, це не пояснює і не дає причин, чому електрони повинні обмежуватися лише певними орбітами. Це безпосередньо передбачає, що електрони мають відомий радіус та орбіту. Однак це не зовсім так. Через десять років Принцип невизначеності Гейзенберга спростував це.
Хоча ця атомна модель змогла моделювати поведінку електронів в атомах водню, вона не була настільки точною, коли мова йде про елементи з більшою кількістю електронів. Це модель, яка має проблеми з поясненням ефекту Зеемана. Цей ефект є тим, що можна побачити, коли спектральні лінії розділені на дві або більше за наявності зовнішнього та статичного магнітного поля.
Ще однією з помилок та обмежень, яку має ця модель, є те, що вона надає неправильне значення кутового моменту орбіти основного стану. Всі ці згадані помилки та обмеження роблять, що атомна модель Бора була замінена квантовою теорією роками пізніше.
Я сподіваюся, що за допомогою цієї статті ви зможете дізнатись більше про атомну модель Бора та її застосування в науці.