У свету физике постоји грана која је одговорна за проучавање трансформација произведених топлотом и радом у систему. Ради се о термодинамика. То је грана физике која је задужена за проучавање свих трансформација које су само резултат процеса који укључују промене променљивих стања температуре и енергије на макроскопском нивоу.
У овом чланку ћемо вам рећи све што треба да знате о термодинамици и принципима термодинамике.
Главне карактеристике
Ако радимо анализу класичне термодинамике, видимо да се она заснива на концепту макроскопског система. Овај систем није ништа друго него део физичке или концептуалне масе који је одвојен од спољашњег окружења. Да би се боље проучавали термодинамички системи, увек се претпоставља да се ради о физичкој маси коју не нарушава размена енергије са спољним екосистемом.
Стање макроскопског система шта је у равнотежним условима је одређен величинама које се називају термодинамичким променљивим. Знамо све ове променљиве, а то су температура, притисак, запремина и хемијски састав. Све ове променљиве су оно што дефинише системе и њихову равнотежу. Главни записи хемијске термодинамике успостављени су захваљујући примењеној међународној унији. Са овим јединицама је могуће радити и боље објаснити закон термодинамике.
Међутим, постоји грана термодинамике која не проучава равнотежу, али је одговорна за анализу термодинамичких процеса које углавном карактеришу немајући способност постизања услова равнотеже на стабилан начин.
Закони
Принципи су денунцирани током XNUMX. века Исаа који Они су задужени за регулисање свих трансформација и њиховог напретка. Такође анализирају која су стварна ограничења како би се постигла права концепција. То су аксиоми који се не могу доказати, али су недоказиви на основу искуства. Свака теорија термодинамике заснива се на овим принципима. Можемо да разликујемо 3 основна принципа плус принцип, али то је онај који дефинише температуру и који је имплицитан у остала 3 принципа.
Нулти закон
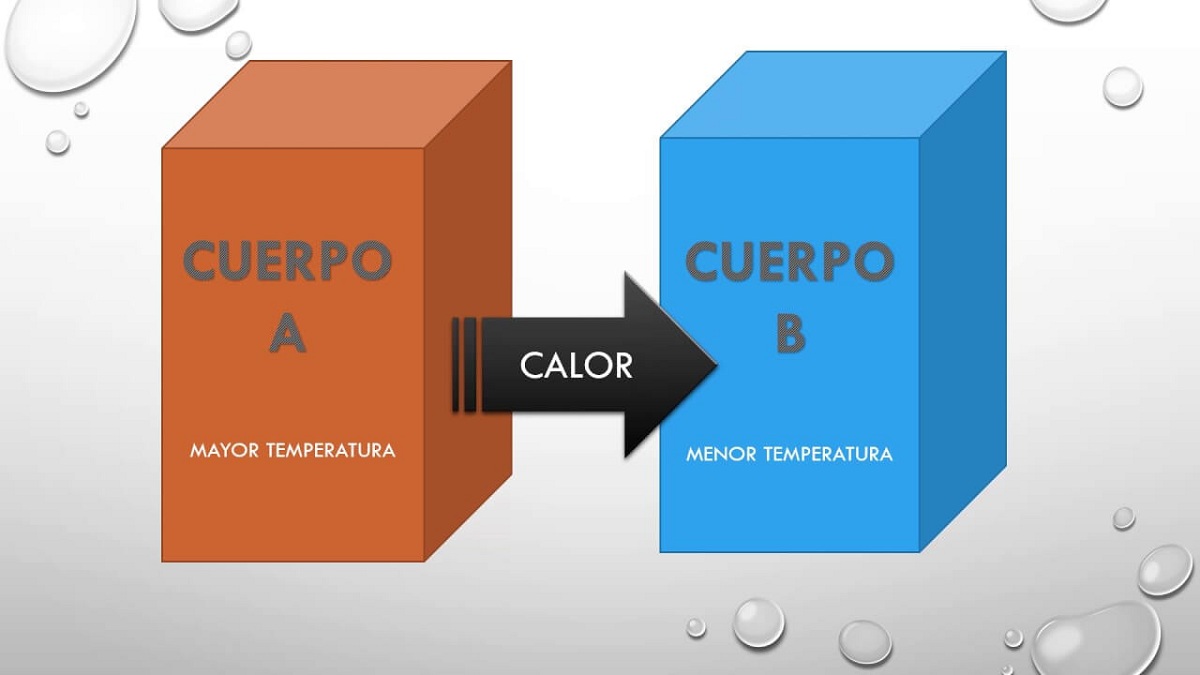
Описаћемо шта је овај нулти закон, који је први који описује температуру која је имплицитна у остатку принципа. Када два система међусобно комуницирају и буду у топлотној равнотежи, деле нека својства. Ова својства која међусобно деле могу се измерити и добити нумеричку вредност. Као резултат, ако су два система у равнотежи са трећим, они ће бити у равнотежи једни са другима и својство које се дели је температура.
Стога овај принцип, али једноставно каже да ако тело А је било у равнотежи са телом Б и ово тело Б биће у топлотној равнотежи са телом Ц, тада ће тела А и Ц такође бити у равнотежи термичка. Овај принцип објашњава чињеницу да два тела на различитим температурама могу међусобно размењивати топлоту. Пре или касније оба тела достигну исту температуру, па су у тоталној равнотежи.
Први закон термодинамике
Када се тело стави у контакт са хладнијим телом, долази до трансформације која доводи до стања равнотеже. Ово стање равнотеже заснива се на чињеници да су температура два тела једнака, јер је појачан пренос енергије између врућег тела за хладно тело. Да би објаснили овај феномен, научници су претпоставили да је врућа супстанца која је присутна у већим количинама прошла хладније тело. Мислило се на течност која се може кретати кроз масу како би могла да размењује топлоту.
Овај принцип је одговоран за препознавање топлоте као облика енергије. То није материјална супстанца. На овај начин би се могло показати да су топлота која се мери калоријама и рад који се мери у џулима еквивалентни. Стога то данас знамо 1 калорија је приближно 4,186 џула.
Може се рећи да је први принцип термодинамике принцип очувања енергије. Количина енергије у машини за грејање претвара се у рад и може је видети свака машина која може да произведе такав рад без трошења енергије. Овај први принцип можемо успоставити као: варијација унутрашње енергије затвореног термодинамичког система једнака је разлици која постоји између топлоте која се доводи у систем и посла који тај систем обавља у околини.
Други закон термодинамике
Ово на почетку наводи да је немогуће направити цикличну машину која само резултира преносом топлоте из хладног тела у топло тело. Можемо рећи да је немогуће извршити трансформацију чији ће резултат бити само онај претварања топлоте коју смо извукли из једног извора у механички рад.
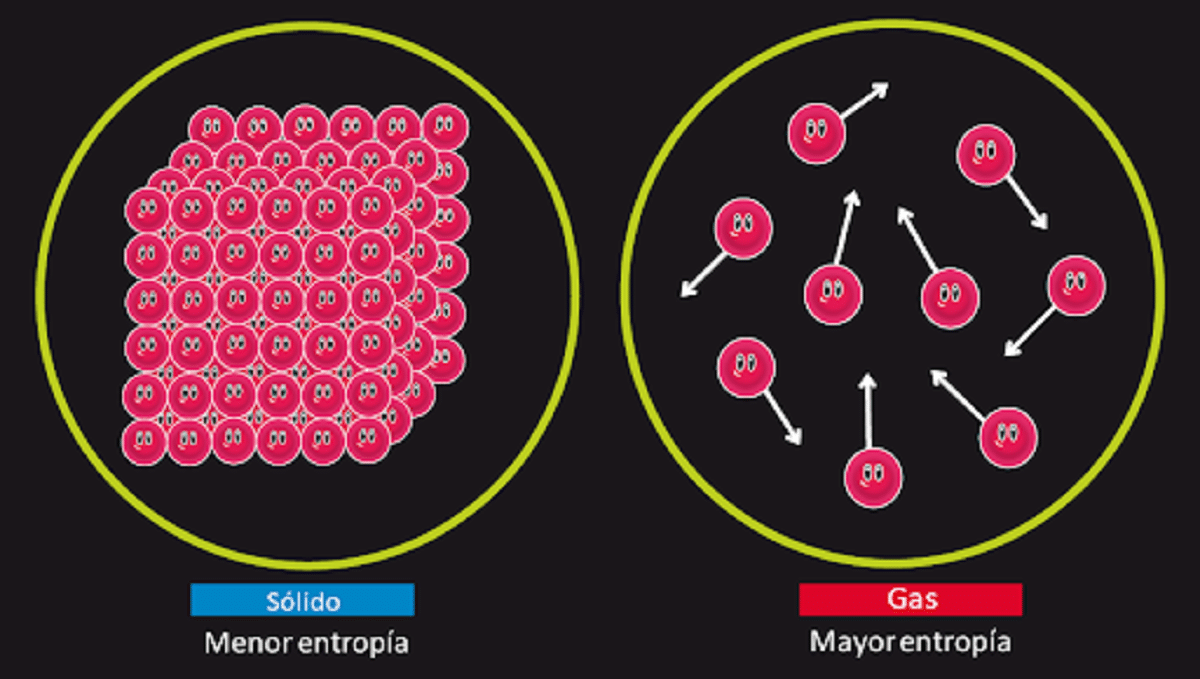
Овај принцип је одговоран за порицање могућности постојања доброг вечитог кретања друге врсте. Знамо да је ентропија система остаје изолован непромењен када се догоди реверзибилна трансформација. Такође знамо да се повећава када се догоди неповратна трансформација.
Трећи закон термодинамике
Овај последњи принцип је уско повезан са другим и сматра се његовом последицом. Овај принцип потврђује да се апсолутно биће не може постићи у боји коначним бројем трансформација. Знамо да апсолутна нула није већа од минималне температуре која се може достићи. У јединицама Келвина знамо да је 0, али у степенима Целзијуса има вредност -273.15 степени.
Такође се наводи да је ентропија за чврсту супстанцу која је савршено кристална са температуром од 0 келвина једнака 0. То значи да ентропије не би било, па би систем био потпуно стабилан. Енергија ослобађања, транслације и ротације честица које га чине не би била ништа на температури од 0 келвина.
Надам се да ћете са овим информацијама сазнати више о термодинамици и основним принципима.