
Јесте ли икада видели Боров атомски модел. Ово је прилично важно откриће које је овај научник направио за науку, посебно за електромагнетизам и електрохемију. Раније је постојао Рутхерфорд модел, који је био прилично револуционаран и врло успешан, али било је сукоба са другим атомским законима као што су Маквелл и Невтон.
У овом чланку ћемо вам рећи све што треба да знате о Боровом атомском моделу, као и његове детаље да бисмо разјаснили све сумње у вези са том темом.
Проблеми које је помогло да се реше
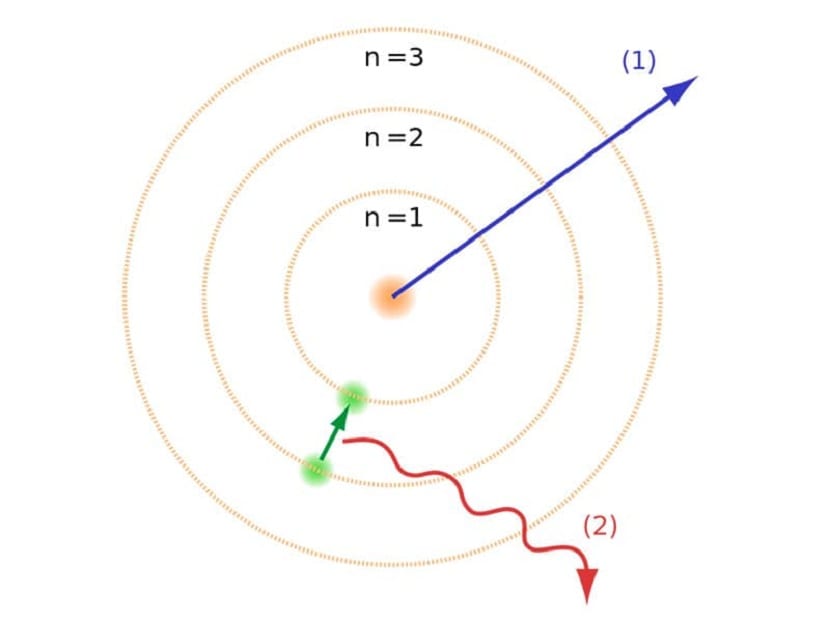
Као што смо споменули на почетку чланка, овај атомски модел је помогао у решавању одређених сукоба који су постојали са другим атомским законима. У претходном моделу Рутхерфорд морали смо електрони који се крећу са негативним електричним набојем морали су да емитују врсту електромагнетног зрачења. Ово би требало да буде испуњено због закона електромагнетизма који постоје тамо. Овај губитак енергије доводи до смањења електрона до њихове орбите спиралним окретањем ка центру. Када су стигли до центра срушили су се, сударајући се са језгром.
Ово је створило проблем у теорији, јер се није могло срушити са језгром атома, али путања електрона морала је бити другачија. То је решено Боровим атомским моделом. То објашњава електрони круже око језгра у одређеним орбитама које су дозвољене и које имају специфичну енергију. Енергија је пропорционална Планцковој константи.
Те орбите које смо поменули где се електрони крећу названи су енергетским слојевима или нивоима енергије. Односно, енергија коју имају електрони није увек иста, већ је квантизована. Квантни нивои су различите орбите у којима се налазе атоми. Зависно од тога у којој се орбити налази у датом тренутку, имаће више или мање енергије. Орбите ближе језгру атома имају већу количину енергије. С друге стране, што је даље од језгра то је мање енергије.
Модел нивоа енергије
Овај Боров атомски модел, који је подразумевао да електрони енергију могу добити или изгубити само скакањем са једне орбите на другу, помогао је да се реши колапс који је предложио Рутхерфордов модел. Приликом преласка са једног нивоа енергије на други, он апсорбује или емитује електромагнетно зрачење. Односно, када скочите са напуњенијег нивоа енергије на мање напуњен, ослобађате вишак енергије. Супротно томе, када пређе са ниског нивоа енергије на виши, он апсорбује електромагнетно зрачење.
Како је овај атомски модел модификација Рутхерфордовог модела, задржавају се карактеристике малог централног језгра и са већином масе атома. Иако орбите електрона нису равне попут оних на планетама, могло би се рећи да се ови електрони окрећу око свог језгра на сличан начин као планете око Сунца.
Борови принципи атомског модела

Сада ћемо анализирати принципе овог атомског модела. Ради се о детаљном објашњењу наведеног модела и његовог рада.
- Честице које имају позитиван набој Ниске су концентрације у поређењу са укупном запремином атома.
- Електрони са негативним електричним набојем су они који се налазе у ротацији око језгра у кружним орбитама енергије.
- Постоје нивои енергије у орбитама кроз које електрони циркулишу. Такође имају постављену величину, тако да између орбита не постоји средње стање. Они само прелазе са једног нивоа на други.
- Енергија коју поседује свака орбита повезана је са њеном величином. Што је орбита даље од језгра атома, то више енергије има.
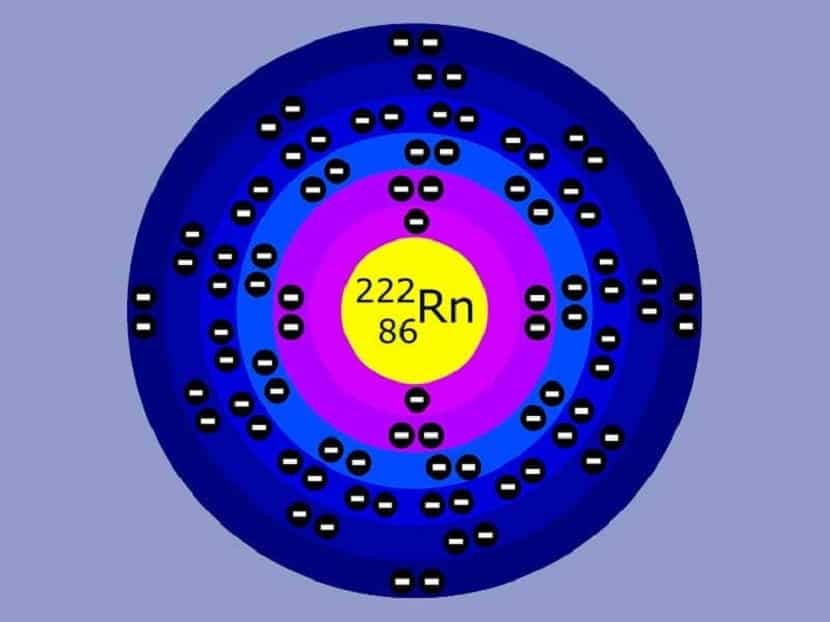
- Енергетски нивои имају различит број електрона. Што је нижи ниво енергије, то садржи мање електрона. На пример, ако смо на првом нивоу, биће до два електрона. На нивоу 2 може бити до 8 електрона, итд.
- Када се електрони крећу из једне орбите у другу, они апсорбују или ослобађају електромагнетну енергију. Ако пређете са једног енергетског нивоа на други мање, ослобађате вишак енергије и обрнуто.
Овај модел је био револуционаран и трудио се да материјалу да стабилност који претходни модели нису имали. Овим атомским моделом такође су објашњени дискретни спектри емисије и апсорпције гасова. То је био први модел који је увео концепт квантизације или квантизације. То чини Боров атомски модел моделом на пола пута између класичне механике и квантне механике. Иако такође има недостатака, био је претходник за каснију квантну механику Сцхродингера и других научника.
Ограничења и грешке Боровог атомског модела
Као што смо напоменули, овај модел такође има одређене недостатке и грешке. Пре свега, то не објашњава нити даје разлоге зашто електрони морају бити ограничени само на одређене орбите. Директно претпоставља да електрони имају познати радијус и орбиту. Међутим, то није тако. Деценију касније Хајзенбергов принцип неизвесности ово је оповргнуо.
Иако је овај атомски модел успео да моделира понашање електрона у атомима водоника, није био тако тачан када су у питању елементи са већим бројем електрона. То је модел који има проблема са објашњавањем Зеемановог ефекта. Овај ефекат је оно што се може видети када се спектралне линије поделе на два или више у присуству спољног и статичког магнетног поља.
Још једна од грешака и ограничења која овај модел има је та што пружа нетачну вредност угаоног момента орбите основног стања. Све ове поменуте грешке и ограничења чине да је Боров атомски модел годинама касније замењен квантном теоријом.
Надам се да ћете помоћу овог чланка сазнати више о Боровом атомском моделу и његовим применама у науци.