
Ste že kdaj videli Bohrov atomski model. To je zelo pomembno odkritje, ki ga je ta znanstvenik naredil za znanost, zlasti za elektromagnetizem in elektrokemijo. Prej je obstajal model Rutherford, ki je bil precej revolucionaren in zelo uspešen, vendar je bilo nekaj konfliktov z drugimi atomskimi zakoni, kot sta Maxwellov in Newtonov.
V tem članku vam bomo povedali vse, kar morate vedeti o Bohrovem atomskem modelu, in podrobnosti, da razjasnimo dvome o tej temi.
Težave, ki jih je pomagal rešiti
Kot smo omenili na začetku članka, je ta atomski model pomagal razrešiti določene konflikte, ki so obstajali z drugimi atomskimi zakoni. V prejšnjem Rutherfordovem modelu smo morali elektroni, ki se gibljejo z negativnim električnim nabojem, so morali oddajati vrsto elektromagnetnega sevanja. To bi moralo biti izpolnjeno zaradi zakonov elektromagnetizma tam zunaj. Ta izguba energije povzroči, da se elektroni s spirali proti središču zmanjšajo v svojo orbito. Ko so prišli do središča, so se sesuli in trčili v jedro.
To je v teoriji povzročilo problem, saj se z jedrom atomov ni mogel zrušiti, toda pot elektronov je morala biti drugačna. To je bilo rešeno z Bohrovim atomskim modelom. To pojasnjuje elektroni krožijo okoli jedra v določenih orbitah, ki so dovoljene in imajo določeno energijo. Energija je sorazmerna s Planckovo konstanto.
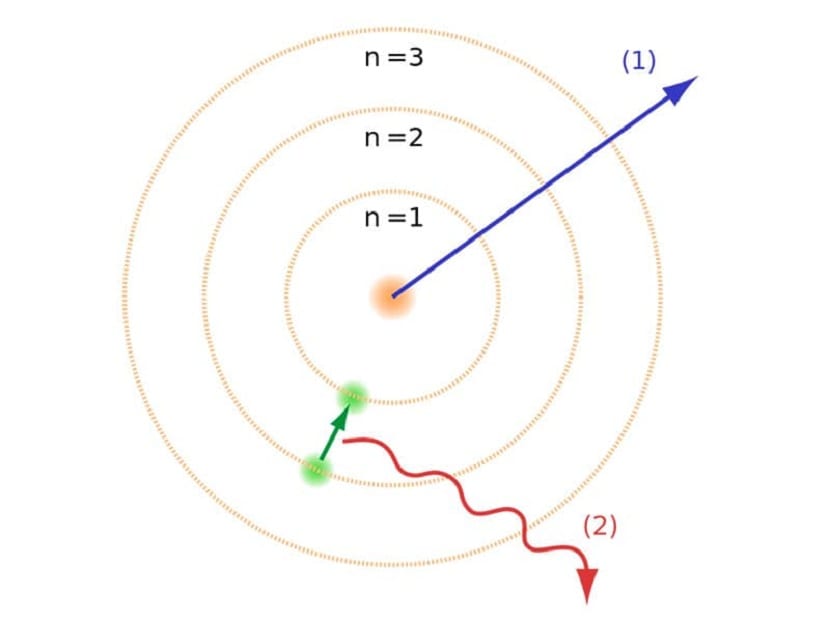
Te orbite, ki smo jih omenili, kjer se elektroni premikajo, so se imenovale energijske plasti ali ravni energije. To pomeni, da energija, ki jo imajo elektroni, ni vedno enaka, ampak je kvantizirana. Kvantne ravni so različne orbite, v katerih so atomi. Glede na to, v kateri orbiti je v danem trenutku, bo imel več ali manj energije. Orbite, ki so bližje jedru atoma, imajo večjo količino energije. Po drugi strani, bolj ko se odmikajo od jedra, manj energije.
Model ravni energije
Ta Bohrov atomski model, ki je pomenil, da lahko elektroni pridobivajo ali izgubljajo energijo samo s preskakovanjem z ene orbite na drugo, je pomagal rešiti kolaps, ki ga je predlagal Rutherfordov model. Ko prehaja z ene ravni energije na drugo, absorbira ali oddaja elektromagnetno sevanje. Se pravi, ko skočite z bolj nabito energijske ravni na manj nabito, sprostite odvečno energijo. Nasprotno pa, ko prehaja z nizke ravni energije na višjo, absorbira elektromagnetno sevanje.
Ker je ta atomski model modifikacija Rutherfordovega modela, se ohranijo značilnosti majhnega osrednjega jedra in z večino mase atoma. Čeprav orbite elektronov niso ravne kot pri planetih, bi lahko rekli, da se ti elektroni vrtijo okoli svojega jedra na podoben način kot planeti okoli Sonca.
Bohrova načela atomskega modela

Zdaj bomo analizirali principe tega atomskega modela. Gre za podrobno razlago omenjenega modela in njegovega delovanja.
- Delci, ki imajo pozitiven naboj So v nizki koncentraciji v primerjavi s celotno prostornino atoma.
- Elektroni z negativnim električnim nabojem so tisti, ki se vrtijo okoli jedra v krožnih orbitih energije.
- Obstajajo ravni energije orbit, skozi katere krožijo elektroni. Imajo tudi nastavljeno velikost, zato med orbitama ni vmesnega stanja. Samo prehajajo z ene stopnje na drugo.
- Energija, ki jo ima vsaka orbita, je odvisna od njene velikosti. Bolj ko je orbita od jedra atoma, več energije ima.
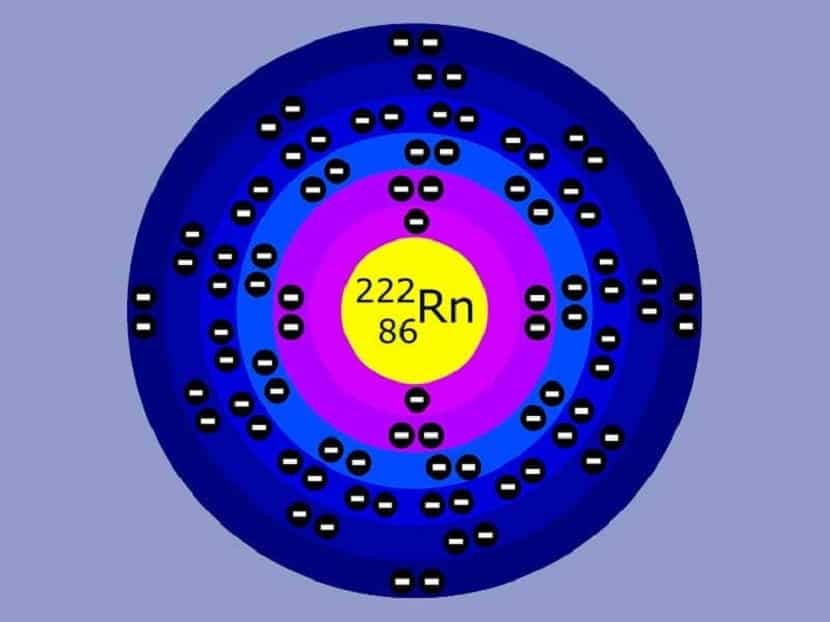
- Energijske ravni imajo različno število elektronov. Nižja kot je raven energije, manj elektronov vsebuje. Če smo na primer na prvi stopnji, bosta do dva elektrona. Na 2. stopnji je lahko do 8 elektronov, tako naprej.
- Ko se elektroni premikajo iz ene orbite v drugo, absorbirajo ali sproščajo elektromagnetno energijo. Če prehajate z ene ravni energije na drugo manj, sproščate preostalo energijo in obratno.
Ta model je bil revolucionaren in poskušal je materialu zagotoviti stabilnost, ki je prejšnji modeli niso imeli. S tem atomskim modelom smo razložili tudi diskretni emisijski in absorpcijski spekter plinov. To je bil prvi model, ki je predstavil koncept kvantizacije ali kvantizacije. Zaradi tega je Bohrjev atomski model model, ki je na pol poti med klasično mehaniko in kvantno mehaniko. Čeprav ima tudi pomanjkljivosti, je bil predhodnik za poznejšo kvantno mehaniko Schrödingerja in drugih znanstvenikov.
Omejitve in napake Bohrovega atomskega modela
Kot smo že omenili, ima ta model tudi nekatere pomanjkljivosti in napake. Najprej ne pojasni ali navede razlogov, zakaj bi morali biti elektroni omejeni le na določene orbite. Neposredno predpostavlja, da imajo elektroni znani polmer in orbito. Vendar temu ni tako. Desetletje pozneje Heisenbergovo načelo negotovosti je to ovrglo.
Čeprav je ta atomski model znal modelirati obnašanje elektronov v vodikovih atomih, pri elementih z večjim številom elektronov ni bil tako natančen. To je model, ki ima težave z razlago Zeemanovega učinka. Ta učinek je tisto, kar je mogoče videti, če so spektralne črte razdeljene na dve ali več v prisotnosti zunanjega in statičnega magnetnega polja.
Druga napaka in omejitve, ki jih ima ta model, je ta, da zagotavlja napačno vrednost kotnega momenta orbite osnovnega stanja. Zaradi vseh omenjenih napak in omejitev je Bohrov atomski model leta kasneje zamenjala kvantna teorija.
Upam, da boste s tem člankom izvedeli več o Bohrovem atomskem modelu in njegovih aplikacijah v znanosti.