
După cunoștință Modelul atomic al lui Thomson, care considera electronii într-un mediu încărcat pozitiv, un model mai avansat cunoscut sub numele de Modelul atomic Rutherford. Omul de știință care se ocupa de acest nou avans pentru știință a fost Ernest Rutherford. S-a născut la 20 august 1871 și a murit la 19 octombrie 1937. În timpul vieții sale a adus mari contribuții la chimie și la lumea științei în general.
Prin urmare, vom dedica acest articol pentru a vă spune tot ce trebuie să știți despre modelul atomic al lui Rutherford.
Experiment cu frunze de aur
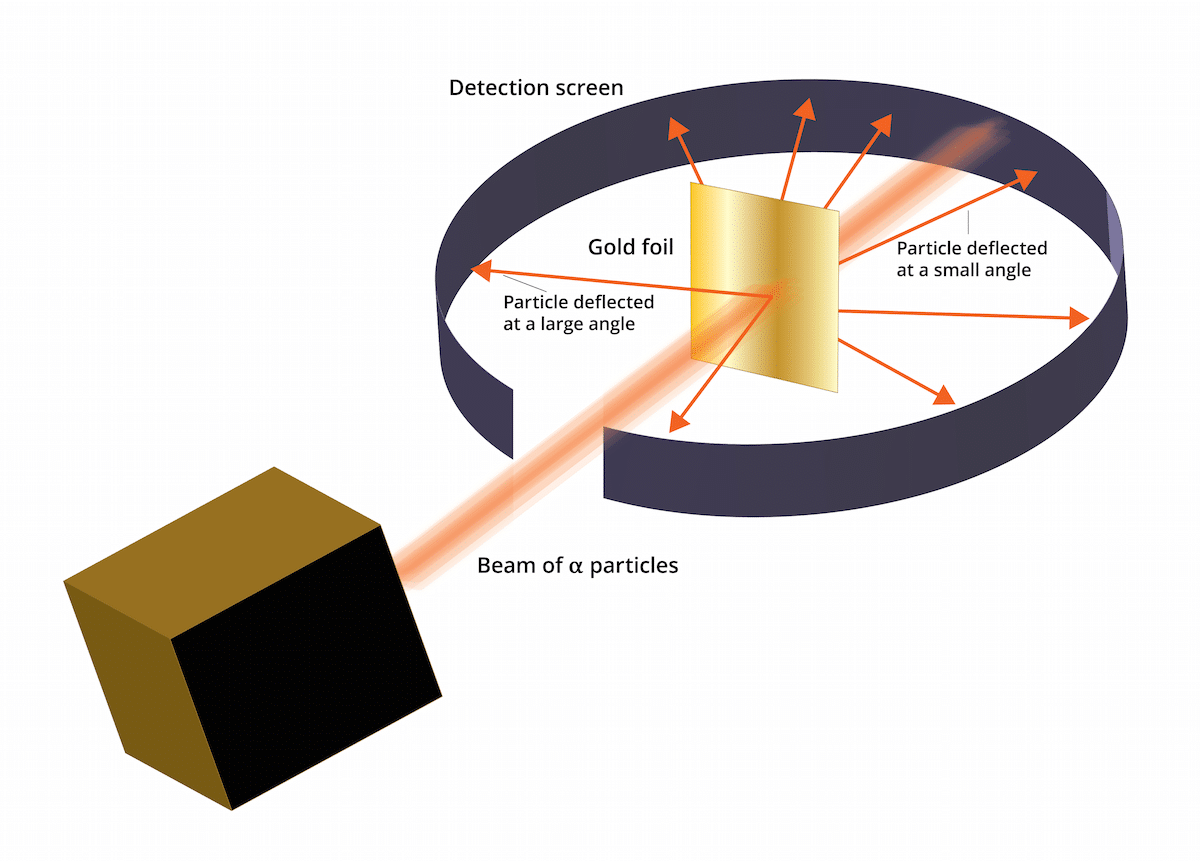
Vechiul model Thomson spunea că electronii se aflau într-un mediu încărcat pozitiv. În 1909, Ernest Rutherford, însoțit de doi asistenți pe nume Geiger și Marsden, a făcut un studiu cunoscut sub numele de experimentul Gold Leaf, unde au putut verifica că Cunoscuta „budincă de stafide” a lui Thomson a greșit. Și acest nou experiment a reușit să demonstreze că atomul avea o structură cu o puternică sarcină pozitivă. Acest experiment ar putea ajuta la restabilirea unor concluzii care au ajuns să fie prezentate ca model atomic al lui Rutherford în 1911.
Experimentul cunoscut sub numele de Gold Leaf nu a fost unic, dar au fost efectuate între 1909 și 1913. Pentru aceasta, au folosit laboratoarele de fizică ale Universității din Manchester. Aceste experimente au avut o mare importanță, deoarece noi rezultate au putut fi stabilite din rezultatele lor, ceea ce a dus la un model atomic revoluționar.
Acest experiment a constat în următoarele: o foaie subțire de aur cu o grosime de numai 100nm trebuia bombardată cu o cantitate mare de particule alfa. Aceste particule alfa erau și ioni. Adică, atomi care nu au electroni, deci au avut doar protoni și neutroni. Având neutroni și protoni, sarcina totală a atomului a fost pozitivă. Acest experiment a avut în principal obiectivul de a confirma dacă modelul Thomson a fost corect. Dacă acest model a avut dreptate, particulele alfa trebuiau să treacă prin atomii de aur în linie dreaptă.
Pentru a studia deformarea cauzată de particulele alfa, un filtru fluorescent de sulfură de zinc a trebuit să fie plasat în jurul foliei de aur fină. Rezultatul acestui experiment este că s-a observat că unele particule au putut să treacă prin atomii de aur ai foii în linie dreaptă. Cu toate acestea, unele dintre aceste particule alfa au fost deviate în direcții aleatorii.
Concluziile experimentului Gold Leaf

Având în vedere acest fapt, nu a fost posibil să se coroboreze ceea ce sunt considerate modelele atomice anterioare. Și este faptul că aceste modele atomice au subliniat că sarcina pozitivă a fost distribuită uniform în atomi și acest lucru ar face mai ușor să o traverseze, deoarece sarcina sa nu ar fi atât de puternică la un moment dat.
Rezultatele acestui experiment Gold Leaf au fost total neașteptate. Acest lucru l-a făcut pe Rutherford să creadă că atomul avea un centru cu o încărcătură pozitivă puternică care se făcea atunci când o particulă alfa încercați să-l distribuiți respins de structura centrală. Pentru a stabili o sursă mai fiabilă, particulele au fost luate în considerare în cantități dintre cele care au fost reflectate și cele care nu. Datorită acestei selecții de particule, a fost posibil să se determine dimensiunea nucleului în comparație cu orbita electronilor din jurul său. S-ar putea concluziona, de asemenea, că cea mai mare parte a spațiului unui atom este gol.
Se putea vedea, unele particule alfa au fost deviate de folia de aur. Unele dintre ele s-au abătut doar în unghiuri foarte mici. Acest lucru a ajutat la concluzia că sarcina pozitivă pe un atom nu este distribuită uniform. Adică sarcina pozitivă este localizată pe un atom într-un mod concentrat într-un volum foarte mic de spațiu.
Foarte puține particule alfa au plecat înapoi. Această abatere indică după cum urmează, particulele menționate ar fi putut reveni. Datorită tuturor acestor noi considerații, modelul atomic al lui Rutherford ar putea fi stabilit cu idei noi.
Modelul atomic Rutherford

Vom studia care sunt principiile modelului atomic al lui Rutherford:
- Particule care au o sarcină pozitivă în interiorul unui atom sunt aranjate într-un volum foarte mic dacă îl comparăm cu volumul total al atomului menționat.
- Aproape toată masa pe care o are un atom se află în acel volum mic menționat. Această masă interioară a fost numită nucleu.
- Electronii care au sarcini negative se găsesc rotind în jurul nucleului.
- Electronii se rotesc la viteze mari atunci când sunt în jurul nucleului și fac acest lucru pe căi circulare. Aceste traiectorii au fost numite orbite. Mai târziu o voi face sunt cunoscuți ca orbitali.
- Atât acei electroni care au fost încărcați negativ, cât și nucleul atomului încărcat pozitiv sunt întotdeauna ținuți împreună datorită forței de atracție electrostatică.
Acceptarea și limitările modelului atomic al lui Rutherford
Așa cum era de așteptat, acest nou model a imaginat o nouă perspectivă asupra atomului în lumea științifică. Datorită acestui model atomic, mulți oameni de știință de mai târziu au putut studia și determina numărul de electroni pe care îl are fiecare element din tabelul periodic. În plus, s-ar putea face noi descoperiri care ajută la explicarea funcționării unui atom în cel mai simplu mod.
Cu toate acestea, acest model are și unele limitări și erori. Deși a fost o descoperire în lumea fizicii, nu au fost nici un model perfect, nici un model complet. Și este aceea a conform legilor lui Newton și un aspect important al legilor lui Maxwell, acest model nu a putut explica anumite lucruri:
- El nu a putut explica modul în care sarcinile negative au reușit să se țină împreună în nucleu. Conform tibiei electronice, sarcinile pozitive trebuie să se respingă reciproc.
- O altă contradicție a fost față de legile fundamentale ale electrodinamicii. Dacă s-ar considera că electronii cu sarcină pozitivă se rotesc în jurul nucleului, ar trebui să emită radiații electromagnetice. La emiterea acestei radiații, energia este consumată pentru ca electronii să se prăbușească în nucleu. Prin urmare, modelul atomic striat nu poate explica stabilitatea atomului.
Sper că cu aceste informații puteți afla mai multe despre modelul atomic al lui Rutherford.