
Depois do conhecido Modelo atômico de Thomson, que considerava os elétrons em um meio carregado positivamente, um modelo mais avançado conhecido como Modelo atômico de Rutherford. O cientista responsável por esse novo avanço da ciência foi Ernest Rutherford. Ele nasceu em 20 de agosto de 1871 e morreu em 19 de outubro de 1937. Durante sua vida, ele fez grandes contribuições para a química e para o mundo da ciência em geral.
Portanto, vamos dedicar este artigo para dizer tudo o que você precisa saber sobre o modelo atômico de Rutherford.
Experiência Folha de Ouro
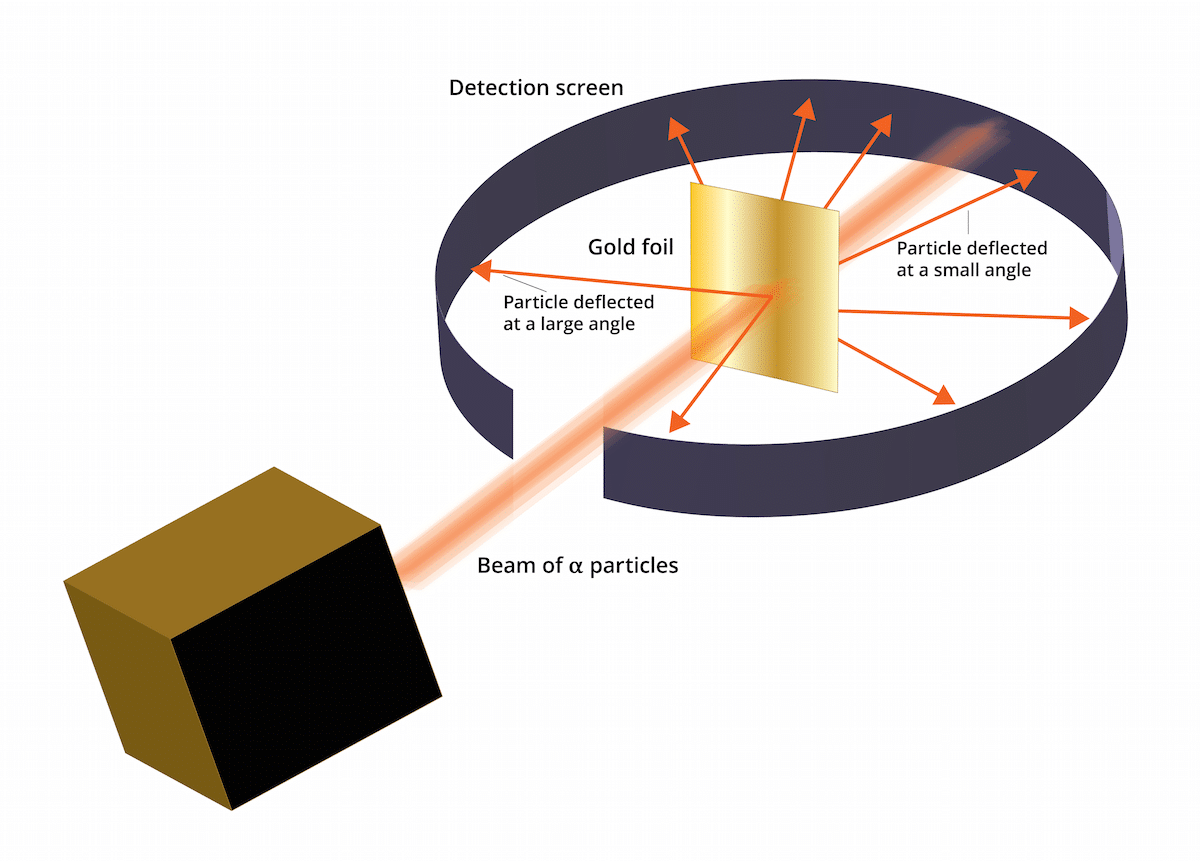
O antigo modelo thomson dizia que os elétrons estavam em um meio com carga positiva. Em 1909, Ernest Rutherford, acompanhado por dois assistentes chamados Geiger e Marsden, fez um estudo conhecido como o experimento Gold Leaf, onde puderam verificar que O conhecido "pudim de passas" de Thomson estava errado. E é que esse novo experimento foi capaz de mostrar que o átomo tinha uma estrutura com uma forte carga positiva. Este experimento ou poderia ajudar a restabelecer algumas conclusões que acabaram sendo apresentadas como o modelo atômico de Rutherford em 1911.
O experimento conhecido como Folha de Ouro não foi o único, mas foi realizado entre 1909 e 1913. Para isso, eles usaram os laboratórios de física da Universidade de Manchester. Esses experimentos foram de grande importância, uma vez que novas conclusões puderam ser estabelecidas a partir de seus resultados, o que levou a um modelo atômico revolucionário.
Este experimento consistiu no seguinte: uma fina folha de ouro de apenas 100 nm de espessura teve que ser bombardeada com uma grande quantidade de partículas alfa. Essas partículas alfa eram e íons. Ou seja, átomos que não têm elétrons, então eles só tinham prótons e nêutrons. Por ter nêutrons e prótons, a carga total do átomo era positiva. Este experimento teve como principal objetivo corroborar se o modelo de Thomson estava correto. Se este modelo estivesse certo, as partículas alfa tiveram que passar pelos átomos de ouro em linha reta.
Para estudar a deflexão causada pelas partículas alfa, um filtro fluorescente de sulfeto de zinco teve que ser colocado ao redor da fina folha de ouro. O resultado desse experimento é que foi possível observar que algumas partículas conseguiram passar pelos átomos de ouro da folha em linha reta. No entanto, algumas dessas partículas alfa foram desviadas em direções aleatórias.
Conclusões do experimento Gold Leaf

Diante desse fato, não foi possível corroborar o que são considerados os modelos atômicos anteriores. E é que esses modelos atômicos apontavam que a carga positiva se distribuía uniformemente nos átomos e isso tornaria mais fácil cruzá-la, já que sua carga não seria tão forte em determinado ponto.
Os resultados desta experiência Gold Leaf foram totalmente inesperados. Isso fez Rutherford pensar que o átomo tinha um centro com uma forte carga positiva que fez quando uma partícula alfa tente distribuí-lo rejeitado pela estrutura central. Para estabelecer uma fonte mais confiável, as partículas foram consideradas em quantidades daquelas que foram refletidas e das que não foram. Graças a essa seleção de partículas, foi possível determinar o tamanho do núcleo em relação à órbita dos elétrons ao seu redor. Também pode ser concluído que a maior parte do espaço de um átomo está vazio.
Pode-se ver, algumas partículas alfa foram desviadas pela folha de ouro. Alguns deles se desviaram apenas em ângulos muito pequenos. Isso ajudou a concluir que a carga positiva em um átomo não está distribuída uniformemente. Ou seja, a carga positiva está localizada em um átomo de forma concentrada em um volume muito pequeno do espaço.
Muito poucas partículas alfa voltaram. Este desvio indica o seguinte, as referidas partículas podem ter se recuperado. Graças a todas essas novas considerações, o modelo atômico de Rutherford pôde ser estabelecido com novas idéias.
Modelo atômico de Rutherford

Vamos estudar quais são os princípios do modelo atômico de Rutherford:
- Partículas com carga positiva dentro de um átomo eles estão dispostos em um volume muito pequeno se compararmos com o volume total do referido átomo.
- Quase toda a massa que um átomo tem está naquele pequeno volume mencionado. Essa massa interna foi chamada de núcleo.
- Elétrons que têm cargas negativas são encontrados girando em torno do núcleo.
- Os elétrons estão girando em alta velocidade quando estão ao redor do núcleo e o fazem em caminhos circulares. Essas trajetórias foram chamadas de órbitas. Mais tarde eu vou eles são conhecidos como orbitais.
- Tanto os elétrons com carga negativa quanto o núcleo do átomo com carga positiva são sempre mantidos juntos graças à força de atração eletrostática.
Aceitação e limitações do modelo atômico de Rutherford
Como esperado, esse novo modelo vislumbrou um panorama totalmente novo do átomo no mundo científico. Graças a esse modelo atômico, muitos cientistas posteriores puderam estudar e determinar o número de elétrons que cada elemento da tabela periódica possui. Além disso, novas descobertas podem ser feitas para ajudar a explicar o funcionamento de um átomo da maneira mais simples.
No entanto, este modelo também possui algumas limitações e bugs. Embora tenha sido um grande avanço no mundo da física, eles não eram nem um modelo perfeito nem completo. E isso é de de acordo com as leis de Newton e um aspecto importante das leis de Maxwell, este modelo não poderia explicar certas coisas:
- Ele não conseguia explicar como cargas negativas eram capazes de se manter unidas no núcleo. De acordo com a tíbia eletrônica, as cargas positivas devem se repelir.
- Outra contradição era em relação às leis fundamentais da eletrodinâmica. Se os elétrons com carga positiva fossem considerados girando em torno do núcleo, eles deveriam emitir radiação eletromagnética. Ao emitir essa radiação, a energia é consumida para que os elétrons entrem em colapso no núcleo. Portanto, o modelo atômico estriado não pode explicar a estabilidade do átomo.
Espero que com essas informações você possa aprender mais sobre o modelo atômico de Rutherford.