
I vitenskapen har det vært mange forskere som har gjort en forskjell når det gjelder å vite hvordan ting fungerer. Kunnskap om partikler, atomer og elektroner har gitt mange fremskritt innen vitenskap. Derfor skal vi vie denne artikkelen til Thomsons atommodell. Det var også kjent som Raisin Pudding-modellen.
I denne artikkelen kan du lære alt relatert til Thomsons atommodell, hva dens egenskaper er og hvor viktig det var for vitenskapen.
Hva er Thomsons atommodell

Dette er en modell som ble utviklet i 1904, og den første subatomære partikkelen kan ha blitt oppdaget. Oppdageren var den britiske forskeren Joseph John Thomson. Denne mannen var i stand til å oppdage negativt ladede partikler gjennom et eksperiment der han brukte katodestrålerør i 1897.
Konsekvensen av denne oppdagelsen var ganske enorm, siden det ikke var bevis for at atomet kunne ha en kjerne. Denne forskeren får oss til å tro at elektronene var nedsenket i en slags substans med en positiv ladning som motvirker den negative ladningen til elektronene. Det er dette som fikk atomene til å ha nøytral ladning.
Å forklare dem på en måte som er forstått, er som å legge en gelé med rosiner som flyter inni. Derav modellnavnet pudding med rosiner. I denne modellen, Thomson hadde ansvaret for å ringe elektronene til kropp og syntes at de var ordnet på en ikke-tilfeldig måte. I dag er det kjent at de er i en slags roterende ringer, og at hver ring har et annet energinivå. Når et elektron mister energi går det til et høyere nivå, det vil si at det beveger seg bort fra atomkjernen.
Gullfolieeksperiment

Det Thompson mente var at den positive delen av atomet alltid forble på ubestemt tid. Denne modellen som han opprettet i 1904, hadde ikke utbredt akademisk aksept. Fem år senere var Geiger og Marsden i stand til å utføre et eksperiment med en gullfolie som gjorde Thomsons funn mindre effektive. I dette eksperimentet besto de en stråle av helium alfapartikler gjennom en gullfolie. Alfapartikler er ikke annet enn løver av et element, det vil si kjerner som ikke har elektroner og derfor har en positiv ladning.
Resultatet av eksperimentet var at denne bjelken ble spredt når den passerte gjennom gullfolien. Med dette kunne man konkludere med at det måtte være en kjerne med en kilde til positiv ladning som var ansvarlig for å avbøye lysstrålen. På den annen side hadde vi i Thomsons atommodell at den positive ladningen ble fordelt langs det som ble sagt som gelatin og som inneholdt elektronene. Dette betyr at en ionestråle kan passere gjennom atomet til den modellen.
Da det motsatte ble vist i det påfølgende eksperimentet, denne modellen kan nektes atomisk.
Oppdagelsen av elektronet kom også fra en del av en annen atommodell, men fra Dalton. I den modellen ble atom ansett for å være helt udelelig. Dette fikk Thomson til å tenke på sin Raisin Pudding-modell.
Kjennetegn ved Thomson atommodell
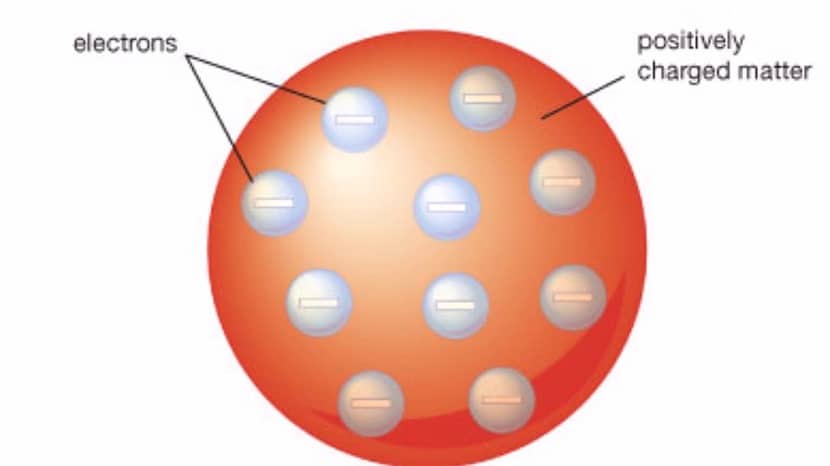
Blant de viktigste egenskapene til denne modellen oppsummerer vi følgende:
- Atomet som denne modellen representerer ligner en sfære som har et positivt ladet materiale med elektroner som er negativt ladet. Både elektroner og positivt ladet materie er tilstede inne i sfæren.
- De positive og negative ladningene har samme størrelse. Dette betyr at hele atomet ikke har noen ladning, men er elektrisk nøytralt.
- Slik at atomet generelt kan ha en nøytral ladning elektronene trenger å bli nedsenket i et stoff som har en positiv ladning. Det er det som er nevnt med rosiner som en del av elektronene, og resten av gelatinen er den delen med en positiv ladning.
- Selv om det ikke er forklart på en eksplisitt måte, kan det utledes at atomkjernen ikke fantes i denne modellen.
Da Thomson opprettet denne modellen, forlot han den forrige hypotesen om nebularatomet. Denne hypotesen var basert på at atomer var sammensatt av immaterielle virvler. Å være en dyktig forsker ønsket han å lage sin egen atommodell basert på eksperimentelle bevis som var kjent i hans tid.
Til tross for at denne modellen ikke var helt nøyaktig, var den i stand til å bistå med legging av faste baser slik at senere modeller kunne bli mer vellykkede. Takket være denne modellen var det mulig å utføre forskjellige eksperimenter som førte til nye konklusjoner, og det er hvordan vitenskapen vi kjenner i dag utviklet seg mer og mer.
Begrensninger og feil i Thomson atommodell
Vi skal analysere hvilke problemer denne modellen ikke lyktes i, og hvorfor den ikke kunne fortsette. Det første er at han ikke kunne forklare hvordan ladningene opprettholdes på elektronene i atomet. Ikke i stand til å forklare dette, han kunne heller ikke løse noe om stabiliteten til et atom.
I teorien nevnte han ikke noe om atomet hadde en kjerne. Hadde vi i dag visst at atomet består av kjernen består av protoner og nøytroner og elektroner roterer rundt på forskjellige energinivåer.
Protoner og nøytroner ville ennå ikke blitt oppdaget. Thompson prøvde å basere sin modell på en forklaring med elementene som var vitenskapelig bevist på den tiden. Da gullfolieeksperimentet ble bekreftet, ble det raskt kastet. I dette eksperimentet ble det vist at det måtte være noe inne i atomet som ville få det til å ha en positiv ladning og en større masse. Dette er allerede kjent for å være atomkjernen.
Jeg håper at du med denne informasjonen kan lære mer om Thomsons atommodell.