In de wereld van de natuurkunde is er een tak die verantwoordelijk is voor het bestuderen van de transformaties geproduceerd door warmte en het werken in een systeem. Het gaat over de thermodynamica. Het is een tak van de natuurkunde die verantwoordelijk is voor het bestuderen van alle transformaties die alleen het gevolg zijn van processen die veranderingen in de toestandsvariabelen van zowel temperatuur als energie op macroscopisch niveau met zich meebrengen.
In dit artikel gaan we je alles vertellen wat je moet weten over thermodynamica en de principes van thermodynamica.
hoofdkenmerken
Als we de klassieke thermodynamica analyseren, zien we dat het gebaseerd is op het concept van macroscopisch systeem. Dit systeem is niets meer dan een deel van de fysieke of conceptuele massa dat gescheiden is van de externe omgeving. Om thermodynamische systemen beter te kunnen bestuderen, wordt altijd aangenomen dat het een fysieke massa is die niet wordt verstoord door de uitwisseling van energie met het externe ecosysteem.
De toestand van een macroscopisch systeem wat is onder evenwichtsomstandigheden wordt het gespecificeerd door grootheden die thermodynamische variabelen worden genoemd. We kennen al deze variabelen en ze zijn temperatuur, druk, volume en chemische samenstelling. Al deze variabelen bepalen de systemen en hun evenwicht. De belangrijkste notaties in de chemische thermodynamica zijn tot stand gekomen dankzij de toegepaste internationale unie. Met deze eenheden is het mogelijk om te werken en de wet van de thermodynamica beter uit te leggen.
Er is echter een tak van de thermodynamica die geen evenwicht bestudeert, maar verantwoordelijk is voor het analyseren van thermodynamische processen die voornamelijk worden gekenmerkt door niet in staat zijn om op een stabiele manier evenwichtsomstandigheden te bereiken.
wetten
De principes werden aan de kaak gesteld tijdens de XNUMXe eeuw Isa degenen die Ze zijn verantwoordelijk voor het reguleren van alle transformaties en hun voortgang. Ze analyseren ook wat de echte limieten zijn om een ware opvatting te hebben. Het zijn axioma's die niet kunnen worden bewezen, maar niet bewezen kunnen worden op basis van ervaring. Elke theorie van thermodynamica is gebaseerd op deze principes. We kunnen 3 basisprincipes onderscheiden plus het principe, maar dat is degene die de temperatuur definieert en dat is impliciet in de andere 3 principes.
Geen wet
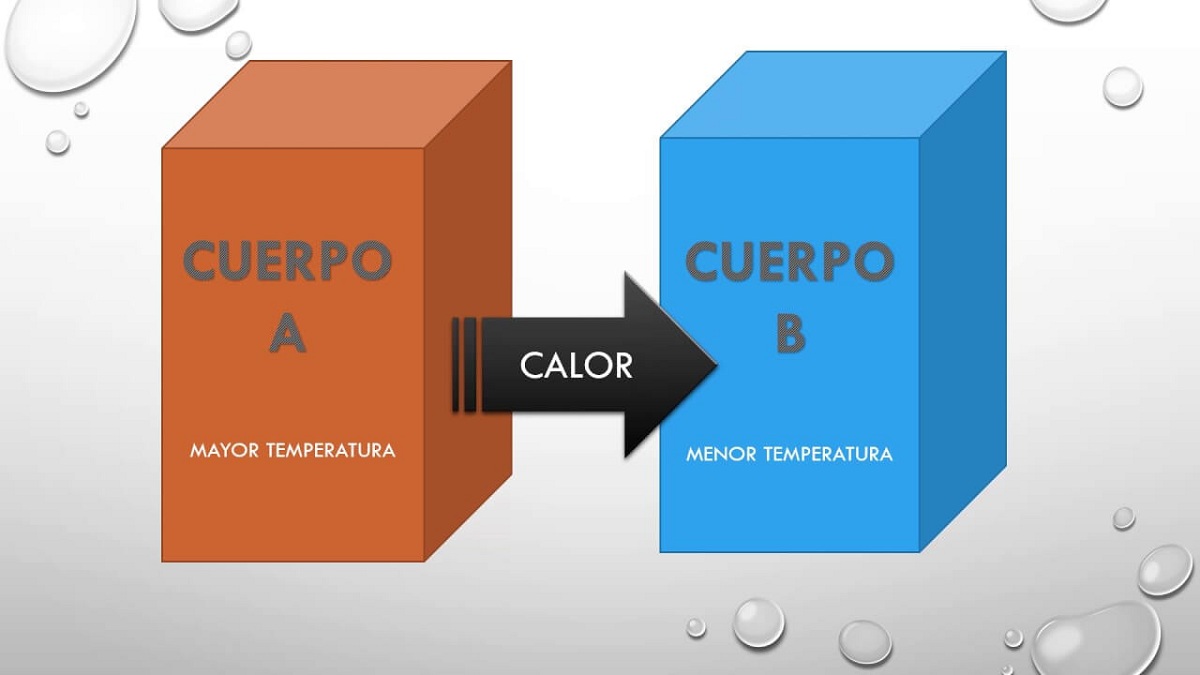
We gaan beschrijven wat deze nulwet is, de eerste die de temperatuur beschrijft die impliciet in de rest van de principes zit. Wanneer twee systemen met elkaar interageren en in thermisch evenwicht zijn, delen ze enkele van de eigenschappen. Deze eigenschappen die ze met elkaar delen, kunnen worden gemeten en een numerieke waarde krijgen. Als gevolg hiervan, als de twee systemen in evenwicht zijn met een derde, zullen ze in evenwicht zijn met elkaar en is de eigenschap die wordt gedeeld temperatuur.
Daarom stelt dit principe gewoon dat als een lichaam A was in evenwicht met een lichaam B en dit lichaam B zal in thermisch evenwicht zijn met een lichaam C, dan zullen de lichamen A en C ook in evenwicht zijn thermisch. Dit principe verklaart het feit dat twee lichamen met verschillende temperaturen warmte met elkaar kunnen uitwisselen. Vroeg of laat bereiken beide lichamen dezelfde temperatuur, zodat ze in totaal evenwicht zijn.
Eerste wet van de thermodynamica
Wanneer een lichaam in contact wordt gebracht met een lichaam dat kouder is, vindt er een transformatie plaats die leidt tot een staat van evenwicht. Deze evenwichtstoestand is gebaseerd op het feit dat de temperatuur van de twee lichamen gelijk is, aangezien een overdracht van energie tussen het warme lichaam voor het koude lichaam wordt versterkt. Om dit fenomeen te verklaren, gingen de wetenschappers ervan uit dat een hete substantie die in grotere hoeveelheden aanwezig is, een kouder lichaam passeert. Er werd gedacht aan een vloeistof die door de massa kon bewegen om warmte uit te wisselen.
Dit principe is verantwoordelijk voor het identificeren van warmte als een vorm van energie. Het is geen materiële substantie. Op deze manier zou kunnen worden aangetoond dat warmte, die wordt gemeten in calorieën, en werk, dat wordt gemeten in joules, equivalent zijn. Daarom weten we dat vandaag 1 calorie is ongeveer 4,186 joules.
Men kan zeggen dat het eerste principe van thermodynamica een principe van behoud van energie is. Een hoeveelheid energie in een warmtemotor wordt omgezet in werk en kan worden gezien door elke machine die dergelijk werk kan produceren zonder energie te verbruiken. We kunnen dit eerste principe vaststellen als: de variatie van de interne energie van een gesloten thermodynamisch systeem is gelijk aan het verschil dat bestaat tussen de warmte die aan het systeem wordt geleverd en het werk dat door dat systeem in de omgeving wordt gedaan.
Tweede wet van de thermodynamica
Dit stelt in het begin dat het onmogelijk is om een cyclische machine te maken die alleen resulteert in de overdracht van warmte van een koud lichaam naar een warm lichaam. We kunnen zeggen dat het onmogelijk is dat er een transformatie kan worden uitgevoerd waarvan het resultaat alleen zal zijn die van het omzetten van de warmte die we uit één bron hebben gehaald in mechanisch werk.
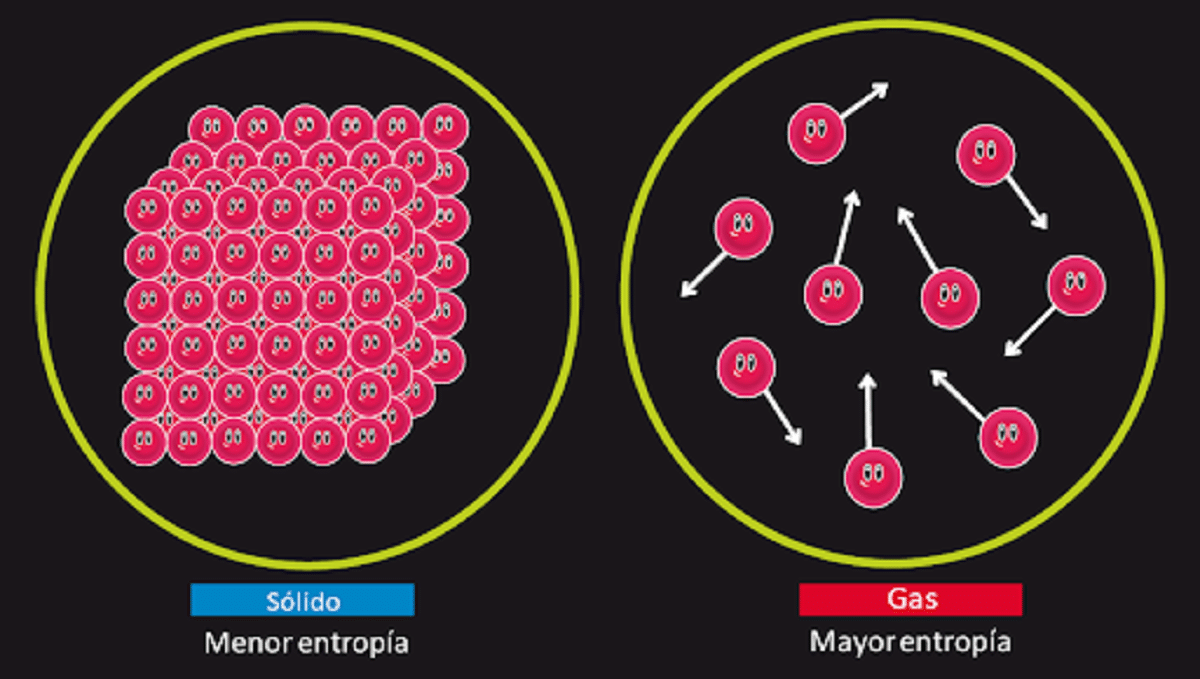
Dit principe is verantwoordelijk voor het ontkennen van de mogelijkheid dat er de welbekende eeuwigdurende beweging van de tweede soort is. We weten dat de entropie van een systeem blijft onveranderd geïsoleerd wanneer een omkeerbare transformatie plaatsvindt. We weten ook dat het toeneemt als er een onomkeerbare transformatie plaatsvindt.
Derde wet van de thermodynamica
Dit laatste principe is nauw verwant aan het tweede en wordt als een gevolg ervan beschouwd. Dit principe bevestigt dat absoluut zijn niet in kleur kan worden bereikt met een eindig aantal transformaties. We weten dat er een absoluut nulpunt is dat niet meer is dan de minimumtemperatuur die kan worden bereikt. In eenheden Kelvin we weten dat het 0 is, maar in graden Celsius heeft het een waarde van -273.15 graden.
Het stelt ook dat de entropie voor een vaste stof die perfect kristallijn is met een temperatuur van 0 kelvin gelijk is aan 0. Dit betekent dat er geen entropie zou zijn, dus het systeem zou volledig stabiel zijn. De energie van bevrijding, translatie en rotatie van de deeltjes waaruit het bestaat, zou niets zijn bij een temperatuur van 0 kelvin.
Ik hoop dat je met deze informatie meer leert over thermodynamica en basisprincipes.