
La De wet van Boyle het werd ontdekt door Robert Boyle in de XNUMXe eeuw en legde de basis om de relatie tussen druk en volume in gassen te verklaren. Door een reeks experimenten slaagde hij erin aan te tonen dat als de temperatuur constant is, een gas zijn volume vermindert wanneer het aan meer druk wordt blootgesteld en in volume toeneemt als de druk wordt verlaagd.
In dit artikel gaan we je alles vertellen wat je moet weten over de wet van Boyle, de kenmerken en het belang ervan.
hoofdkenmerken
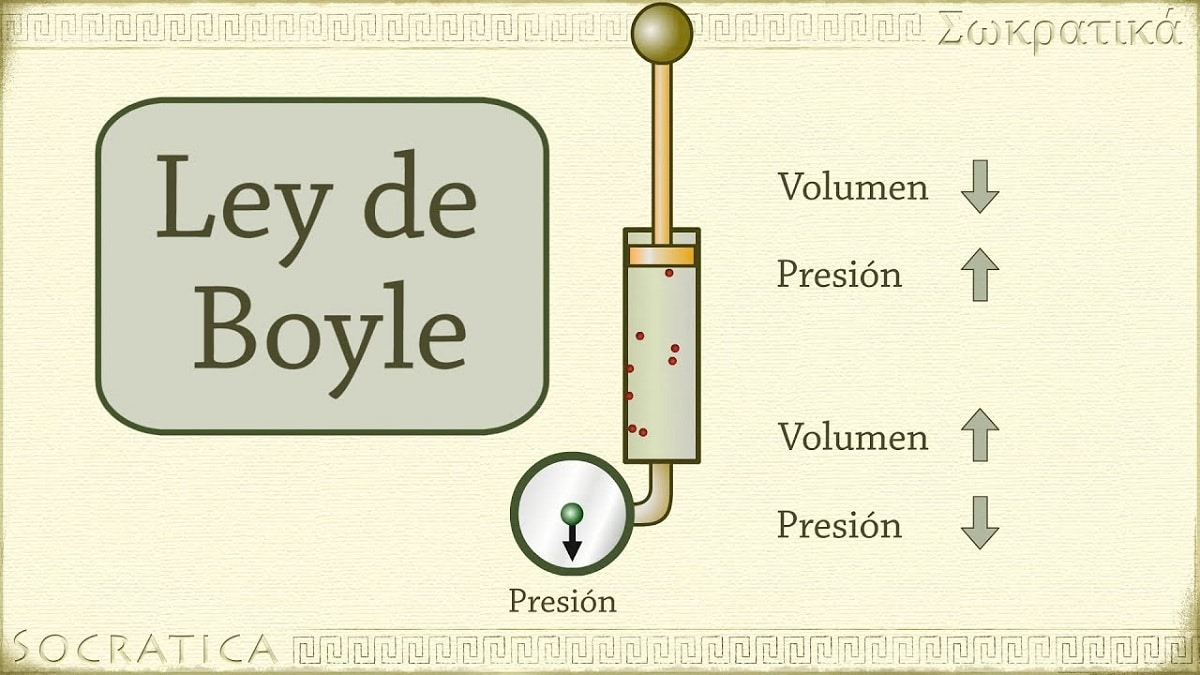
In 1662 ontdekte Robert Boyle dat de druk die op een gas wordt uitgeoefend omgekeerd evenredig is met het volume en het aantal mol bij constante temperatuur. Met andere woorden, als de druk die op een gas wordt uitgeoefend wordt verdubbeld, hetzelfde gas wordt gecomprimeerd en het volume wordt gehalveerd.
Naarmate het volume van de container die het gas bevat toeneemt, neemt ook de afstand die de deeltjes moeten afleggen voordat ze in botsing komen met de containerwanden toe. Door deze toename in afstand kan de frequentie van de schokken afnemen, zodat de druk op de muur minder is dan voorheen toen het volume kleiner was.
De wet van Boyle werd voor het eerst ontdekt in 1662 door Robert Boyle. Edme Mariotte was een andere wetenschapper die dacht en tot dezelfde conclusies kwam als BoyleMariotte maakte zijn werk echter pas in 1676 openbaar. Daarom vinden we in veel boeken deze wet genaamd de wet van Boyle en Mariot, de wet van Boyle-Mariot, ook bekend als de wet van Mattut, ontwikkeld door de Britse natuurkundige en scheikundige Robert. onafhankelijk door Boyle en de Franse natuurkundige en botanicus Edmé Mattout.
Het verwijst naar een van de wetten die het volume en de druk van een gas relateren aan een bepaalde hoeveelheid gas die op een constante temperatuur wordt gehouden. De wet van Boyle stelt het volgende: De druk uitgeoefend door een kracht is fysisch omgekeerd evenredig met het volume van gasvormige materie zolang de temperatuur constant blijft. Of eenvoudiger, we kunnen het interpreteren als: bij een hogere constante temperatuur is het volume van een vaste gasmassa omgekeerd evenredig met de constante druk die het uitoefent.
Experimenten en toepassingen van de wet van Boyle

Om de theorie van de wet van Boyle te bewijzen, was Mariot verantwoordelijk voor het inbrengen van gas in een cilinder met een zuiger en was hij in staat om de verschillende drukken te verifiëren die werden gecreëerd toen de zuiger daalde. Uit dit experiment wordt afgeleid dat naarmate het volume toeneemt, de druk afneemt.
De wet van Boyle heeft veel toepassingen in het moderne leven, waaronder we bijvoorbeeld duiken kunnen noemen, dit komt omdat de duiker de lucht uit zijn longen moet verdrijven tijdens het opstijgen omdat deze uitzet als de druk afneemt, anders kan dit weefselbeschadiging veroorzaken.
Het wordt aangetroffen in alle apparatuur die gebruik maakt van of wordt aangedreven door pneumatische kracht, zoals robotarmen die componenten gebruiken zoals pneumatische zuigers, actuatoren, drukregelaars en overdrukventielen.
Benzine-, gas- of dieselmotoren gebruiken ook de wet van Boyle tijdens interne verbranding, omdat de eerste keer dat lucht de cilinder binnenkomt met volume en druk, de tweede keer het volume vermindert door de druk te verhogen.
Auto's hebben airbagsystemen die werken door een bepaalde hoeveelheid lucht of gas uit een kamer te verdrijven die de buitenairbag bereikt, waar de druk afneemt en het volume toeneemt, waarbij een constante temperatuur wordt gehandhaafd.
De wet van Boyle is tegenwoordig erg belangrijk omdat het de wet is die tot ons spreekt en het gedrag van gassen verklaart. Het verklaart zeker dat de druk en het volume van een gas omgekeerd evenredig zijn met elkaar. Daarom, wanneer druk op een gas wordt uitgeoefend, neemt het volume af en neemt de druk toe.
ideaal gasmodel

De wet van Boyle-Mariotte is van toepassing op zogenaamde ideale gassen, een theoretisch model dat het gedrag van elk gas aanzienlijk vereenvoudigt, ervan uitgaande dat:
- gas moleculen ze zijn zo klein dat het niet nodig is om na te denken over hun maat, vooral als je bedenkt dat dit veel kleiner is dan de afstand die ze afleggen.
- Bovendien heeft de moleculen hebben nauwelijks interactie, behalve wanneer ze heel kort botsen, en wanneer ze dat doen, is de botsing elastisch, dus zowel momentum als kinetische energie blijven behouden.
- Stel ten slotte dat deze kinetische energie evenredig is met de temperatuur van het gasvormige monster, dat wil zeggen, hoe meer geagiteerd de deeltjes, hoe hoger de temperatuur.
Lichte gassen, ongeacht hun identiteit, volgen deze richtlijnen zeer strikt onder standaardomstandigheden van temperatuur en druk (dwz: 0ºC en atmosferische druk (1 atmosfeer). Voor deze gassen beschrijft de wet van Boyle-Mariotte hun gedrag zeer nauwkeurig. .
Aangezien P∙V constant is bij een bepaalde temperatuur, verandert het volume als de druk van het gas verandert, zodat het product hetzelfde blijft, dus in twee verschillende toestanden 1 en 2, kan de gelijkheid als volgt worden uitgedrukt:
P1∙V1 = P2∙V2
Als je dan de ene toestand kent, plus een variabele uit de andere toestand, kun je de ontbrekende variabele kennen door deze uit de wet van Boyle-Mariot te verwijderen.
Geschiedenis van de wet van Boyle
Britse scheikundige. Pionier van experimenten op het gebied van chemie, vooral in de eigenschappen van gassen,
Robert Boyle's proefschrift over het gedrag van materie op deeltjesniveau was een voorloper van de moderne theorie van chemische elementen. Hij was ook een van de oprichters van de Royal Society of London.
Robert Boyle werd geboren in een adellijke familie in Ierland en bezocht de beste Engelse en Europese scholen. Van 1656 tot 1668 was hij de assistent van Robert Hooke aan de universiteit van Oxford, waar hij met hem samenwerkte aan een reeks experimenten die de fysieke eigenschappen van lucht bepaalden en hoe deze brandt, ademt en geluid doorgeeft.
De resultaten van deze bijdragen werden verzameld in hun "Nieuwe fysisch-mechanische experimenten met de elasticiteit van lucht en de effecten ervan"» (1660). In de tweede editie van dit werk (1662) onthulde hij de beroemde eigenschap van gassen, de wet van Boyle-Mariotte, die stelt dat het volume dat wordt ingenomen door een gas bij constante temperatuur omgekeerd evenredig is met zijn druk. Tegenwoordig is bekend dat aan deze wet alleen wordt voldaan wanneer het theoretische ideale gedrag van gassen wordt geaccepteerd.
Ik hoop dat je met deze informatie meer te weten kunt komen over de wet van Boyle, zijn kenmerken en toepassingen in de wetenschappelijke wereld.