
Het atoom is de basiseenheid van materie en is de kleinste fractie die een chemisch element kan identificeren. Het bestaat uit een atoomkern die neutronen en protonen bevat, en elektronen rond de kern. De term atoom is afgeleid van het Grieks en betekent ondeelbaar. Veel mensen weten het echter niet goed Wat is een atoom noch wat zijn de kenmerken ervan.
Daarom gaan we dit artikel wijden om u te vertellen wat een atoom is, zijn kenmerken en belang.
Wat is een atoom

Atomen bestaan uit een centraal deel, de kern genaamd, waarin zich protonen (positief geladen deeltjes) en neutronen (elektrisch neutrale deeltjes) bevinden. Het gebied rond de kern wordt ingenomen door elektronen (negatief geladen deeltjes); dit gebied wordt de elektrische laag genoemd. De elektrische schaal (negatief geladen) en de kern (positief geladen) worden bij elkaar gehouden door elektrische aantrekking.
De gemiddelde diameter van een atoom is ongeveer 10-10 meter, en de gemiddelde diameter van een kern is ongeveer 10-15 meter; dus, een atoom heeft een diameter van 10.000 tot 100.000 keer groter dan zijn kern. Als een atoom bijvoorbeeld zo groot is als een voetbalveld, zal de kern even groot zijn als de bal in het midden van het veld. Als een atoom een diameter heeft van 100 meter, heeft zijn kern een diameter van 1 centimeter.
Een beetje geschiedenis

De Griekse filosoof Aristoteles (384 vC – 322 vC) probeerde de samenstelling van alle materie te verklaren uit de elementen: aarde, lucht, vuur en water. Democritus (546 v.Chr. - 460 v.Chr.) was een Griekse wetenschapper en wiskundige die het idee voorstelde dat er een limiet was aan de grootte van deeltjes. Deze deeltjes worden zo klein dat ze niet meer kunnen worden verdeeld, zei hij. Hij noemde dergelijke deeltjes 'atomen'.
Het grootste deel van de XNUMXe eeuw was het het atoommodel van de Britse wetenschapper Dalton die de atoomtheorie voorstelde, die het denken van de Ouden in die tijd ver te boven ging.
Deze theorie zegt dat Alle materie bestaat uit kleine ondeelbare deeltjes die atomen worden genoemd. Recent onderzoek heeft aangetoond dat atomen zijn opgebouwd uit andere kleine deeltjes die subatomaire deeltjes worden genoemd.
Historisch gezien zijn er verschillende atomaire theorieën over de samenstelling van materie ontwikkeld voordat de huidige kennis over de atomaire structuur werd verkregen. Gebaseerd op de atoomtheorie, Wetenschappers hebben geleidelijk evoluerende modellen van atomen gedemonstreerd.
Het eerste door John Dalton voorgestelde model ontwikkelde zich tot het model van het atoom van Niels Bohr. Bohr stelde een model voor dat erg lijkt op het huidige model van elektronen die rond de kern draaien.
structuur van een atoom
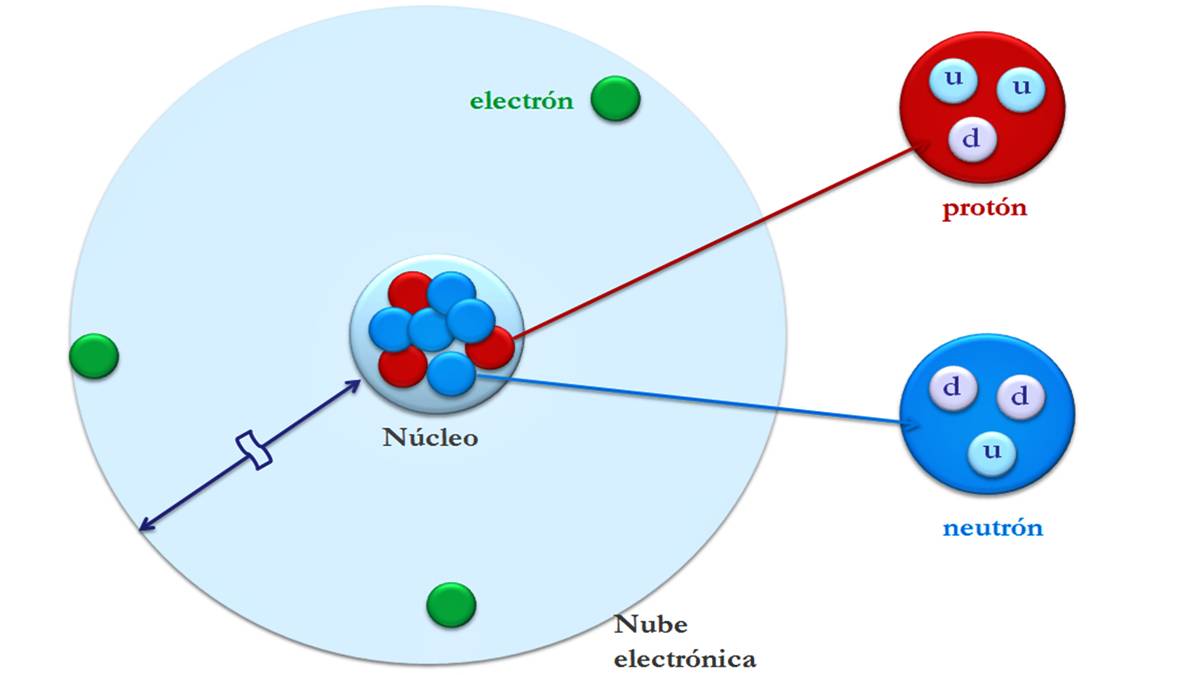
Atomen zijn opgebouwd uit kleine deeltjes die subatomaire deeltjes worden genoemd: elektronen, protonen en neutronen. Het grootste deel van de massa van een atoom is geconcentreerd in de kern. En het grootste volume bevindt zich in de elektrische schil waar de elektronen worden gevonden.
Elektronen, protonen en neutronen
Elektronen zijn negatief geladen en hebben bijna geen massa. De massa is ongeveer 1840 keer die van de atoomkern.. Het zijn kleine deeltjes die rond de centrale kern van een atoom draaien. Bovendien bewegen ze snel rond de kern en genereren ze een elektromagnetisch veld.
Een proton heeft in absolute waarde dezelfde positieve lading als de lading op een elektron, dus protonen en elektronen hebben de neiging elkaar aan te trekken. Deze vormen de eenheid van massa en vormen samen met de neutronen de kern van het atoom.
Neutronen hebben geen lading, dat wil zeggen, ze hebben een neutrale lading. Samen met de protonen het vormt de kern en vertegenwoordigt bijna alle massa (99,9%) van het atoom. Neutronen zorgen voor stabiliteit in de kern.
Atomen hebben energieniveaus, zeven schillen rond de kern waarin elektronen rond de kern draaien. De schillen heten K, L, M, N, O, P en Q. Elke schil kan een eindig aantal elektronen bevatten: acht elektronen per schil. De buitenste laag is altijd de meest dynamische. Alleen het waterstofatoom heeft geen neutronen en er draait maar één elektron om het proton heen.
chemische kenmerken
In de chemie zijn atomen de fundamentele eenheden die gewoonlijk bij elke reactie hun oorspronkelijke eigenschappen behouden. Ze worden niet vernietigd of gecreëerd, ze zijn gewoon op verschillende manieren gerangschikt met verschillende onderlinge verbindingen.
Atomen klonteren samen om moleculen en andere soorten materialen te creëren. De bindingen die ontstaan bij chemische reacties hebben een bepaalde samenstelling die de verschillende chemische elementen onderscheidt. Deze elementen zijn die welke voorkomen op het periodiek systeem der elementen.
Elk van deze elementen heeft veel protonen in de kern. Dit getal wordt het atoomnummer genoemd en wordt aangeduid met de letter Z. Alle atomen met hetzelfde aantal protonen behoren tot hetzelfde element en hebben dezelfde chemische eigenschappen, ook al zijn het verschillende chemische elementen.
Bovendien we vinden het massagetal, aangeduid met de letter A. Dit getal verwijst naar het aantal nucleonen dat in het atoom aanwezig is. Een ander type atoom dat we kunnen vinden en waarvan we het beste weten, is een isotoop. Deze atomen hebben hetzelfde aantal protonen maar verschillende aantallen neutronen. Ze hebben dezelfde chemische eigenschappen, hoewel hun fysische eigenschappen van elkaar verschillen.
Zoals we eerder opmerkten, zijn isotopen erg belangrijk. En ze zijn van vitaal belang voor kernenergie, omdat uraniumverrijking inhoudt dat de ene uraniumisotoop wordt omgezet in een andere uraniumisotoop met een meer onstabiele chemische structuur, waardoor we een kettingreactie kunnen krijgen.
EIGENDOMMEN
De eigenschappen die een atoom definiëren zijn:
- Atoomnummer (Z) dat het aantal protonen in de kern aangeeft. Alle atomen met hetzelfde aantal protonen behoren tot hetzelfde element. Bijvoorbeeld een waterstofatoom met maar één proton.
- Het massagetal verwijst naar de som van protonen en neutronen.. Elementen met verschillende aantallen neutronen zijn verschillende isotopen van hetzelfde element.
- elektronegativiteit Het is de neiging van atomen om elektronen aan te trekken wanneer ze chemische bindingen vormen.
- atomaire straal Het komt overeen met de helft van de afstand tussen twee samengevoegde kernen van hetzelfde element.
- ionisatie potentieel Het is de energie die nodig is om een elektron uit een element te verwijderen.
Ik hoop dat je met deze informatie meer te weten kunt komen over wat een atoom is en wat zijn kenmerken zijn.
ERG GOED
RICARDO