
Zinātnē ir bijuši daudzi zinātnieki, kuri ir izdarījuši pārmaiņas, zinot, kā lietas darbojas. Zināšanas par daļiņām, atomiem un elektroniem ir devušas daudzus sasniegumus zinātnē. Tāpēc mēs veltīsim šo rakstu Tomsona atomu modelis. Tas bija pazīstams arī kā Raisin Pudding modelis.
Šajā rakstā varat uzzināt visu, kas saistīts ar Tomsona atomu modeli, kādas ir tā īpašības un cik svarīgi tas bija zinātnei.
Kāds ir Tomsona atomu modelis

Šis ir modelis, kas tika izstrādāts 1904. gadā, un, iespējams, tika atklāta pirmā subatomiskā daļiņa. Atklājējs bija britu zinātnieks Džozefs Džons Tomsons. Šis vīrietis spēja atklāt negatīvi lādētas daļiņas, veicot eksperimentu, kurā viņš 1897. gadā izmantoja katodstaru lampas.
Šī atklājuma sekas bija diezgan milzīgas, jo nebija pierādījumu, ka atomam varētu būt kodols. Šis zinātnieks liek mums domāt, ka elektroni tika iegremdēti sava veida pozitīvi uzlādētā vielā, kas neitralizē elektronu negatīvo lādiņu. Tas ir tas, kas lika atomiem neitrālu lādiņu.
Izskaidrot tos saprotamā veidā ir tāpat kā ievietot želeju ar rozīnēm, kas peld iekšā. Tādējādi modeļa nosaukums pudiņš ar rozīnēm. Šajā modelī Thomson bija atbildīgs par elektronu izsaukšanu par korpusiem un uzskatīja, ka tie ir sakārtoti nejauši. Šodien ir zināms, ka tie atrodas sava veida rotējošos gredzenos un katram gredzenam ir atšķirīgs enerģijas līmenis. Kad elektrons zaudē enerģiju, tas nonāk augstākā līmenī, tas ir, tas attālinās no atoma kodola.
Zelta folijas eksperiments

Tompsons domāja, ka atoma pozitīvā daļa vienmēr palika bezgalīgi. Šim modelim, kuru viņš izveidoja 1904. gadā, nebija plaša akadēmiskā atzinuma. Piecus gadus vēlāk Geigers un Marsdens varēja veikt eksperimentu ar zelta foliju, kas padarīja Tomsona atklājumus ne tik efektīvus. Šajā eksperimentā viņi izturēja hēlija alfa daļiņu stars caur zelta foliju. Alfa daļiņas nav nekas cits kā elementa lauvas, tas ir, kodoli, kuriem nav elektronu, un tāpēc tiem ir pozitīvs lādiņš.
Eksperimenta rezultāts bija tāds, ka šī sija tika izkliedēta, kad tā šķērsoja zelta foliju. Ar to varēja secināt, ka jābūt kodolam ar pozitīva lādiņa avotu, kas bija atbildīgs par gaismas staru novirzīšanu. No otras puses, Tomsona atomu modelī mums bija tāds, ka pozitīvais lādiņš tika sadalīts pa to, kas tika teikts kā želatīns un kurā bija elektroni. Tas nozīmē, ka jonu stars varētu iziet cauri šī modeļa atomam.
Kad nākamajā eksperimentā tika parādīts pretējais, šo modeli varētu noliegt atomu.
Elektrons tika atklāts arī no cita atomu modeļa, bet no Daltona. Šajā modelī atoms tika uzskatīts par pilnīgi nedalāmu. Tas pamudināja Tomsonu domāt par savu Raisin Pudding modeli.
Tomsona atomu modeļa raksturojums
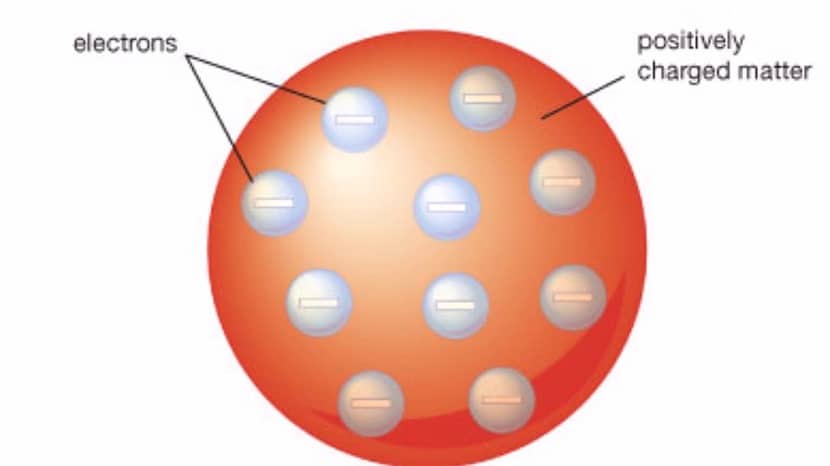
Starp šī modeļa galvenajām īpašībām mēs apkopojam sekojošo:
- Atoms, ko pārstāv šis modelis atgādina sfēru, kurai ir pozitīvi lādēts materiāls ar elektroniem kas ir negatīvi uzlādēti. Sfērā atrodas gan elektroni, gan pozitīvi uzlādēta viela.
- Pozitīvajiem un negatīvajiem lādiņiem ir vienāds lielums. Tas nozīmē, ka atomam kopumā nav lādiņa, bet tas ir elektriski neitrāls.
- Lai atomam kopumā varētu būt neitrāls lādiņš elektronus nepieciešams iegremdēt vielā, kurai ir pozitīvs lādiņš. Tas ir tas, kas minēts ar rozīnēm kā daļu no elektroniem, un pārējais želatīns ir tā daļa, kurai ir pozitīvs lādiņš.
- Lai gan tas nav skaidri izskaidrots, var secināt, ka šajā modelī atoma kodols nepastāvēja.
Kad Tomsons izveidoja šo modeli, viņš atteicās no iepriekšējās hipotēzes par miglāja atomu. Šīs hipotēzes pamatā bija fakts, ka atomus veidoja nemateriālie virpuļi. Būdams zinātnieks, viņš vēlējās izveidot savu atomu modeli, pamatojoties uz eksperimentālajiem pierādījumiem, kas bija zināmi viņa laikā.
Neskatoties uz to, ka šis modelis nebija pilnīgi precīzs, tas spēja palīdzēt izveidot fiksētas bāzes, lai vēlākie modeļi varētu būt veiksmīgāki. Pateicoties šim modelim, bija iespējams veikt dažādus eksperimentus, kuru rezultātā tika izdarīti jauni secinājumi, un tā mūsdienās pazīstamā zinātne attīstījās arvien vairāk.
Thomson atomu modeļa ierobežojumi un kļūdas
Mēs analizēsim, kādi ir jautājumi, kuros šis modelis neizdevās un kāpēc tas nevarēja turpināties. Pirmais ir tas, ka viņš nespēja izskaidrot, kā lādiņi tiek turēti uz elektroniem atoma iekšienē. Nespēdams to izskaidrot, viņš arī neko nevarēja atrisināt par atoma stabilitāti.
Savā teorijā viņš neko neminēja par to, ka atomam ir kodols. Vai šodien mēs zinājām, ka atoms sastāv no kodols, kas sastāv no protoniem un neitroniem, un elektroni rotē apkārt dažādos enerģijas līmeņos.
Protoni un neitroni vēl netiktu atklāti. Tompsons mēģināja balstīt savu modeli uz skaidrojumu ar elementiem, kas tajā laikā bija zinātniski pierādīti. Kad zelta folijas eksperiments tika pārbaudīts, tas ātri tika izmests. Šajā eksperimentā varēja parādīt, ka atoma iekšpusē ir jābūt kaut kam, kas padarītu to ar pozitīvu lādiņu un lielāku masu. Tas jau ir zināms, ka tas ir atoma kodols.
Es ceru, ka ar šo informāciju jūs varat uzzināt vairāk par Tomsona atomu modeli.