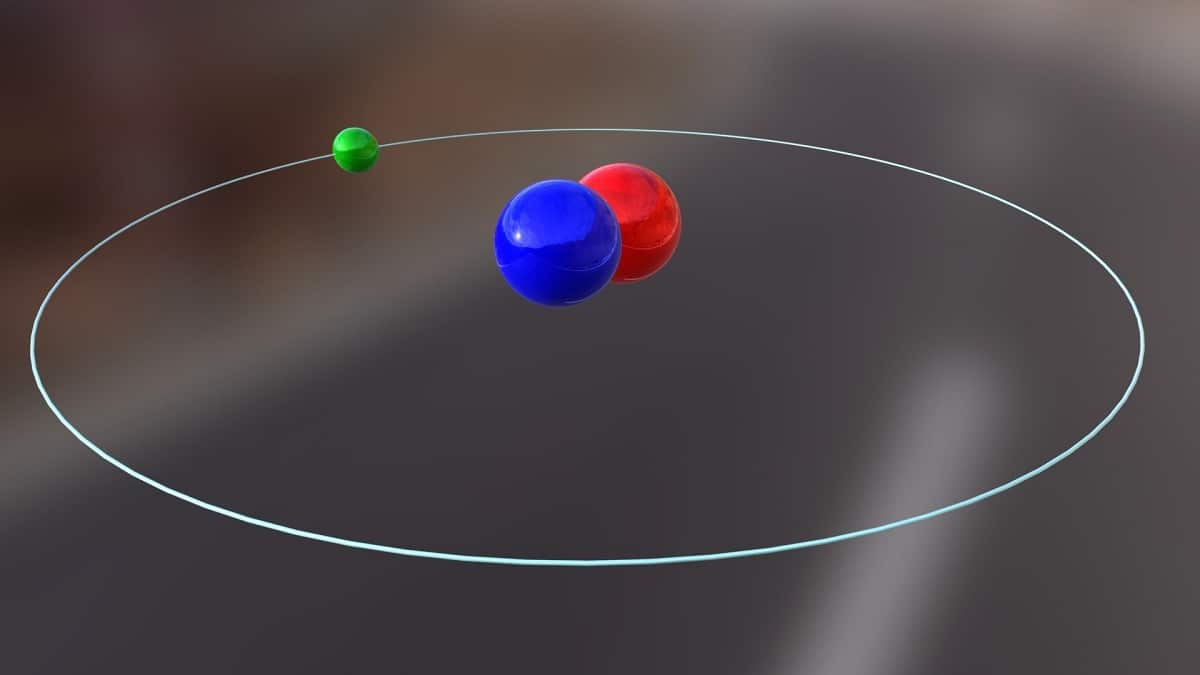
Šodien mēs runāsim par izotopu, ko izmanto kodolenerģijas ražošanai. Tas ir par deitērijs. Tā ir viena no ūdeņraža izotopu sugām, un to attēlo simbols D vai 2H. Tam ir piešķirts parastais nosaukums smagais ūdeņradis, jo masa ir divreiz lielāka par protonu. Izotops ir nekas cits kā suga, kas nāk no tā paša ķīmiskā elementa, bet kurai ir atšķirīgs masas skaitlis. Deitērijs tiek izmantots dažādiem mērķiem.
Tāpēc mēs veltīsim šo rakstu, lai pastāstītu jums par visām deitērija īpašībām, struktūru, īpašībām un lietojumiem.
galvenās iezīmes
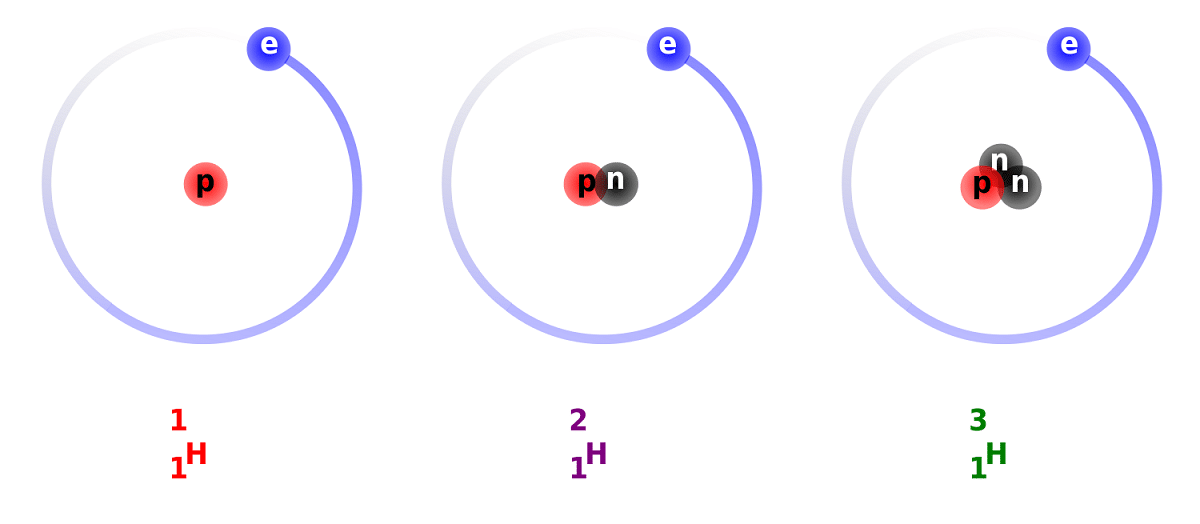
Atšķirība starp deitēriju un ūdeņradi ir saistīta ar tajā esošo neitronu skaita atšķirību. Šī iemesla dēļ deitērijs tiek uzskatīts par stabilu izotopu, un to var atrast savienojumos, kurus veido pilnīgi dabiskas izcelsmes ūdeņradis. Jāpatur prātā, ka, kaut arī tiem ir dabiska izcelsme, tie sastopami nelielā skaitā. Ņemot vērā īpašības, kas tam ir tik līdzīgas kā parastajam ūdeņradim, var to pilnībā aizstāt reakcijās, kurās tā piedalās. Tādā veidā to var pārveidot par līdzvērtīgām vielām.
Šī un citu iemeslu dēļ deitērijam ir daudz pielietojumu dažādās zinātnes jomās. Gadu gaitā tas ir kļuvis par vienu no vissvarīgākajiem elementiem pētniecībā un tehnoloģiju un informācijas attīstībā.
Šī izotopa galveno struktūru veido kodols, kurā ir protons un neitrons. Tā atoma svars ir aptuveni 2,014 grami. Šis izotops tika atklāts, pateicoties Amerikas Savienoto Valstu ķīmiķim Haroldam C. Ūrejam un viņa līdzstrādniekiem Ferdinandam Brikvedem un Džordžam Mērfijam 1931. gadā. Sagatavošanās deitērija satikšanai tīrā stāvoklī pirmo reizi tika veiksmīgi veikta 1933. gadā. Tas notika jau pagājušā gadsimta piecdesmitajos gados, kad sāka izmantot cietu fāzi, kas parādīja lielu stabilitāti, kas pazīstama kā litija deuterīds. Šī viela var aizstāt deitēriju un tritiju daudzās ķīmiskās reakcijās.
Zinātnes attīstība notiek tad, kad tiek atrasta viela, kas var radīt ķīmiskas reakcijas produktu radīšanai. Šajā ziņā, ja jūs pētījāt šī izotopa pārpilnību, lai varētu novērot noteiktas lietas. Ir zināms, ka deitērija īpatsvars ūdenī nedaudz mainās atkarībā no apgabala, kurā ņem paraugu. Ir daži spektroskopijas pētījumi, kas ir noteikuši šī izotopa esamību uz citām mūsu galaktikas planētām. Tam var būt liela nozīme citu debess ķermeņu sastāva izpētē.
Deitērija struktūra un izcelsme

Mēs uzzināsim dažus faktus par deitēriju. Kā mēs jau minējām iepriekš, galvenā atšķirība starp ūdeņraža izotopiem ir to struktūra. Un vai ūdeņradim, deitērijam un tritijam ir atšķirīgs protonu un neitronu daudzums, tāpēc tiem ir dažādas ķīmiskās īpašības. Man arī jāpatur prātā, ka deitērijs, kas pastāv citu zvaigžņu ķermeņu iekšienē, tiek izvadīts ar lielāku ātrumu, nekā tas ir radies. Tas ir viens no iemesliem, kāpēc ir tik grūti izpētīt deitērija klātbūtni zvaigžņu ķermeņos.
Tiek uzskatīts, ka citas dabas parādības veido nenozīmīgu deitērija daudzumu, tāpēc tā ražošana mūsdienās turpina radīt ievērojamu interesi. No iepriekš minētā procentuālā skaita par deitērija klātbūtni dabā tas nesasniedz 0.02%. Virkne zinātnisku pētījumu atklāja, ka lielākā daļa no deitērija izveidojušos atomu dabiski radās sprādziena rezultātā, kas izraisīja Visuma, kas pazīstams kā Big Bang. Tas ir viens no galvenajiem iemesliem, kāpēc tiek uzskatīts, ka deitērijs atrodas lielās planētās, piemēram, Jupiterā.
Visizplatītākais veids, kā dabiski iegūt šo izotopu, ir, ja tos apvieno ar ūdeņradi. Kad tas notiks, tas tiks apvienots starpposma formā. Zinātnieki ir ieinteresēti zināt attiecības, kas izveidojušās starp proporciju deitērijs un ūdeņradis dažādās zinātnes jomās. Tas tiek plaši pētīts tādās zinātnes nozarēs kā astronomija vai klimatoloģija. Šajās nozarēs tam ir daži praktiski pakalpojumi, lai iepazītu un izprastu Visumu un mūsu atmosfēru.
Deitērija īpašības

Mēs uzzināsim, kādas ir šī ūdeņražam piederošā izotopa galvenās īpašības. Vispirms ir jāzina, kas ir izotops, kuram nav radioaktīvu īpašību. Tas nozīmē, ka tam ir diezgan stabils raksturs. To var izmantot ūdeņraža aizstāšanai dažādās ķīmiskās reakcijās. Ar dabisku lielu stabilitāti, parāda atšķirīgu uzvedību nekā parastais ūdeņradis. Tas notiek visās reakcijās, kurām ir bioķīmisks raksturs. Pirms aizstāšanas ir jāzina, ka, kaut arī to var panākt, ķīmiskās reakcijās mainot ūdeņradi pret deitēriju, ir jāzina, ka viņiem būs atšķirīga uzvedība.
Nomainot divus ūdeņraža atomus ūdenī, jūs varat iegūt savienojumu, kas pazīstams kā smagais ūdens. Ūdeņradis, kas atrodas okeānā un kas ir deitērija formā tas ir tikai 0,016% proporcija attiecībā pret starpību. Visumā šim izotopam ir tendence ātrāk saplūst, lai iegūtu hēliju. Ja mēs apvienojam deitēriju ar atomu skābekli, mēs redzam, ka tas kļūst par toksisku sugu. Neskatoties uz to un ķīmiskajām īpašībām vai ļoti līdzīgām ūdeņraža īpašībām.
Vēl viena no šī izotopa īpašībām ir tā, ka tad, kad deitērija atomi tiek pakļauti kodolsintēzes procesam augstā temperatūrā, var izdalīties liels enerģijas daudzums. Tā ir izceļošana, kuru jūs esat pētījis, lai varētu īstenot mūsu planētas kodolsintēzi. Dažas fizikālās īpašības, piemēram, viršanas temperatūra, iztvaikošanas siltums, trīskāršais punkts un blīvums ir lielāki par ūdeņraža lielumiem.
Es ceru, ka ar šo informāciju jūs varat uzzināt vairāk par deitēriju un tā īpašībām.