
Ķīmiskās izmaiņas ir vielas izmaiņas, kas maina tās ķīmisko struktūru, tas ir, maina tās īpašības, ne tikai formu. Tas nozīmē, ka ķīmiskās izmaiņas, kas pazīstamas arī kā ķīmiska reakcija vai ķīmiska parādība, ietver ķīmisko saišu pārraušanu un veidošanos vienā vielā vai savienojumā, veidojot jaunu vielu vai savienojumu. Ir daudz ķīmiskās izmaiņas pasaulē.
Šī iemesla dēļ mēs veltīsim šo rakstu, lai pastāstītu par galvenajām pastāvošajām ķīmiskajām izmaiņām un to piemēru.
Kas ir ķīmiskās izmaiņas?

Ja divas vai vairākas vielas (sauktas par reaģentiem vai reaģentiem) iziet ķīmisku reakciju, mainot to ķīmisko struktūru šajā procesā un spējot patērēt (endotermiskas reakcijas) vai izdala (eksotermiskas reakcijas) enerģiju, radot divas vai vairākas vielas (ko sauc par produktu). Dažas ķīmiskās reakcijas ir bīstamas cilvēkiem, jo tās var ietvert vai radīt toksiskus vai kodīgus savienojumus. Citas reakcijas, piemēram, noteiktas eksotermiskas reakcijas, var izraisīt sprādzienus.
Ķīmiskajā rūpniecībā daudzi materiāli, kurus mēs lietojam ikdienā, tiek ražoti kontrolētu ķīmisku reakciju rezultātā. Dažas reakcijas notiek spontāni, citas ir jārada cilvēkiem rūpnīcās vai ķīmiskajās laboratorijās. Ķīmiskās reakcijas norisei nepieciešams noteikts laiks. atkarībā no reaģentu rakstura un apstākļiem, kādos notiek reakcija.
Tāpēc faktori, kas ietekmē ķīmisko reakciju ātrumu, parasti ietver:
- Temperatūra paaugstinās. Temperatūras paaugstināšanās mēdz palielināt ķīmiskās reakcijas ātrumu.
- paaugstināts spiediens. Spiediena palielināšana parasti palielina ķīmiskās reakcijas ātrumu. Tas parasti notiek, ja reaģē vielas, kas ir jutīgas pret spiediena izmaiņām, piemēram, gāzes. Šķidrumu un cietvielu gadījumā spiediena izmaiņas neizraisa būtiskas izmaiņas to reakcijas ātrumos.
- Reaģentu agregācijas stāvoklis. Cietās vielas parasti reaģē lēnāk nekā šķidrumi vai gāzes, lai gan ātrums ir atkarīgs arī no katras vielas reaktivitātes.
- Katalizatora izmantošana. Tās ir vielas, ko izmanto, lai palielinātu ķīmisko reakciju ātrumu. Šīs vielas netraucē reakciju, tās tikai kontrolē reakcijas norises ātrumu. Ir arī vielas, ko sauc par inhibitoriem, kuras lieto tāpat, bet kurām ir pretējs efekts, palēninot reakciju.
- gaismas enerģija. Dažas ķīmiskās reakcijas paātrina, kad uz tām nokrīt gaisma.
- Reaģenta koncentrācija. Lielākā daļa ķīmisko reakciju notiek ātrāk, ja reaģentu koncentrācija ir augsta.
Ķīmisko izmaiņu piemēri
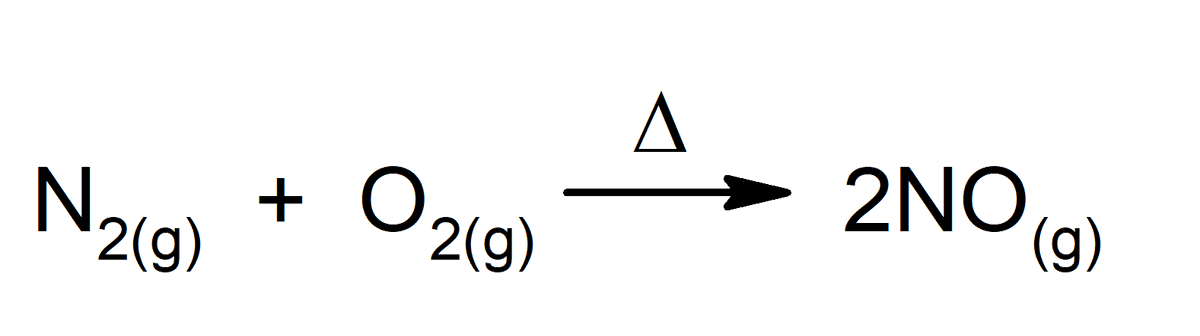
Jebkura ķīmiska reakcija ir lielisks ķīmisko izmaiņu piemērs, pat tās, kas notiek mūsu ķermenī. Daži piemēri:
- Elpošana. Šis ir ķīmiski izmainīts bioloģisks process, kurā skābeklis tiek ņemts no gaisa un izmantots, lai reaģētu ar glikozi, ko iegūstam no pārtikas, radot augstu ķīmiskās enerģijas (ATP) līmeni un lielu daudzumu oglekļa dioksīda (CO2). izdalās.
- Skābais lietus. Tas notiek vidēs ar smagu gaisa piesārņojumu. Tas parasti ir ķīmisku izmaiņu rezultāts starp mākoņos uzkrāto ūdeni un citām gaisā izkliedētām gāzēm, kuru sēra oksīda vai slāpekļa oksīda saturs rada sērskābi vai slāpekļskābi, kas nokrīt ar lietus ūdeni, veidojot sāli. Reakcija, kas notiek akumulatora iekšpusē, ir starp skābi un metālu. Piemēram, akumulators, kas izmanto svinu un sērskābi, rada svina (II) sulfātu, balto sāli. Ozona sadalīšanās. Ozona molekulas kaut kāda veida gaismas ietekmē sadalās skābekļa molekulās.
Ķīmiskās izmaiņas un fiziskās izmaiņas

Vielas fizikālās izmaiņas nemaina tās sastāvu, tas ir, nemaina vielas ķīmisko struktūru, tāpēc vielas nevar sadalīties vai veidot fizikālo izmaiņu rezultātā. Fiziskās izmaiņas vienkārši maina matērijas fizikālās īpašības, piemēram, formu, blīvumu un agregācijas stāvokli (cieta, šķidra, gāzveida). No otras puses, fiziskās izmaiņas Tie parasti ir atgriezeniski, jo maina vielas formu vai stāvokli, bet ne tās sastāvu.
Piemēram, kad ūdens vārās, mēs varam pārvērst šķidrumu gāzē, bet iegūtie tvaiki joprojām sastāv no ūdens molekulām. Un otrādi, ja mēs sasaldējam ūdeni, tas kļūst ciets, bet ķīmiski joprojām ir tā pati viela.
Vēl viens piemērs ir sašķidrinātā gāze, ko izmantojam cigarešu šķiltavās, parasti butāns (C4H10) vai propāns (C3H8), kas pārvēršas šķidrs, ja tiek pielietots augsts spiediens, bet nemaina tā ķīmisko sastāvu.
Ķīmiskās izmaiņas izmaina atomu izkārtojumu un saikni vielā tā, ka tie apvienojas savādāk, kā rezultātā rodas viela, kas atšķiras no sākotnējās vielas. Kad notiek ķīmiskas izmaiņas, jūs vienmēr iegūstat tādu pašu vielas daudzumu, ar kuru sākāt, pat ja tas ir citā proporcijā, jo matēriju nevar radīt vai iznīcināt, bet tikai pārveidot.
Piemēram, ja mēs reaģēsim ar ūdeni (H2O) un kāliju (K), mēs iegūsim divas jaunas vielas: kālija hidroksīdu (KOH) un ūdeņraža gāzi (H2). Tā ir reakcija, kas parasti atbrīvo daudz enerģijas un tāpēc ir ļoti bīstama.
Vielas ķīmisko izmaiņu piemēri
Cepumu vai kūku cepšana
Izplatītas lietas, piemēram, cepumi, kūkas, kūciņas utt. slēpt ķīmisko reakciju, ko sauc par fermentāciju, kurā mīkla paceļas rauga radīto gāzu dēļ. Maizes gatavošanā raugs pārvērš cieti glikozē.
Gremošana
Pārtikas gremošana ir acīmredzams piemērs vielas ķīmiskajai maiņai hidrolīzes rezultātā (organisko vielu sadalīšanās ūdens ietekmē). Pārtika, ko mēs ēdam augļu, dārzeņu, gaļas utt., tie tiek sajaukti ar kuņģa sulu, lai labāk absorbētu barības vielas un pārvērst tos dažādās vielās atbilstoši organisma vajadzībām.
Tajā pašā procesā liekie elementi vai toksīni tiek izvadīti no organisma citādā veidā nekā sākotnējais; fekāliju, urīna, sviedru utt. veidā.
pulque
Fermentācija ir katabolisks process, kurā glikozes molekulas sadalās skābekļa trūkuma dēļ. Daži no alkoholiskajiem dzērieniem, kas iegūti fermentācijas procesā, ir sidrs, alus un mīkstais vīns, pēdējais ir viens no vismazāk zināmajiem dzērieniem pasaulē. Pulque tiek iegūts no agaves auga, izmantojot amatnieku procesul, kurā vielas nogatavināšana ir galvenais, lai iegūtu galaproduktu, kas ir balts, skābs un viskozs, ar ļoti specifisku garšu, kas neatbilst nevienai aukslējai.
Fermentācija notiek arī maizes, jogurta un siera gatavošanas laikā.
Caramelo
Karamele ir pamatpiemērs ķīmiskai vielas maiņai, jo cietais baltais cukurs, dažas minūtes karsēts, pārvēršas dzintara krāsā ar patīkamu aromātu. Citiem vārdiem sakot, tiek radīts produkts, kas pilnīgi atšķiras no oriģināla.
Es ceru, ka ar šo informāciju jūs varat uzzināt vairāk par ķīmiskajām izmaiņām un to piemēriem.