Fizikos pasaulyje yra šaka, atsakinga už transformacijų, kurias sukelia šiluma ir veikia sistemoje, tyrimą. Tai apie termodinamika. Tai yra fizikos šaka, atsakinga už visų transformacijų, atsirandančių tik dėl procesų, susijusių su temperatūros ir energijos būsenos kintamųjų pokyčiais makroskopiniame lygmenyje, tyrimą.
Šiame straipsnyje mes jums pasakysime viską, ką reikia žinoti apie termodinamiką ir termodinamikos principus.
pagrindinės funkcijos
Atlikę klasikinės termodinamikos analizę matome, kad ji remiasi makroskopinės sistemos samprata. Ši sistema yra ne kas kita, kaip fizinės ar konceptualiosios masės dalis, atskirta nuo išorinės aplinkos. Norint geriau ištirti termodinamines sistemas, visada daroma prielaida, kad tai yra fizinė masė, kurios netrikdo energijos mainai su išorine ekosistema.
Makroskopinės sistemos būsena kas yra pusiausvyros sąlygomis jis nurodomas dydžiais, vadinamais termodinaminiais kintamaisiais. Mes žinome visus šiuos kintamuosius ir tai yra temperatūra, slėgis, tūris ir cheminė sudėtis. Visi šie kintamieji apibrėžia sistemas ir jų pusiausvyrą. Pagrindinės cheminės termodinamikos žymės buvo nustatytos taikytos tarptautinės sąjungos dėka. Su šiais vienetais galima dirbti ir geriau paaiškinti termodinamikos dėsnį.
Tačiau yra termodinamikos šaka, kuri netiria pusiausvyros, tačiau yra atsakinga už termodinaminių procesų, kuriems daugiausia būdingas neturintis galimybės stabiliai pasiekti pusiausvyros sąlygų.
Įstatymai
Principai buvo pasmerkti XIX amžiuje Jie yra atsakingi už visų transformacijų ir jų pažangos reguliavimą. Jie taip pat analizuoja, kokios yra tikrosios ribos, kad būtų sukurta tikroji koncepcija. Tai yra aksiomos, kurių neįmanoma įrodyti, tačiau neįmanoma įrodyti remiantis patirtimi. Kiekviena termodinamikos teorija remiasi šiais principais. Galime išskirti 3 pagrindinius principus ir principą, bet tai yra tas, kuris apibrėžia temperatūrą ir yra numanomas kituose 3 principuose.
Nulis įstatymas
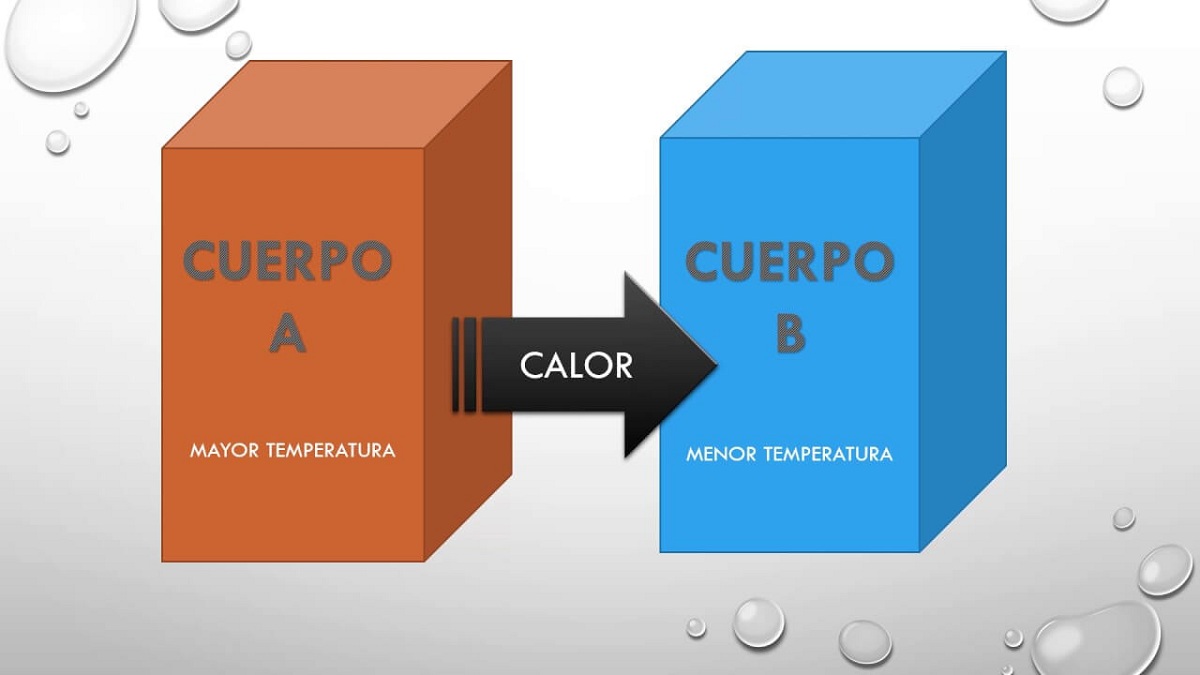
Mes apibūdinsime, koks yra šis nulinis dėsnis, kuris pirmasis apibūdina temperatūrą, kuri numanoma kituose principuose. Kai dvi sistemos sąveikauja tarpusavyje ir būna pusiausvyroje, joms būdingos kai kurios savybės. Šias savybes, kurias jie dalijasi tarpusavyje, galima išmatuoti ir suteikti skaitinę vertę. Dėl to, jei abi sistemos yra pusiausvyroje su trečiąja, jos bus pusiausvyros viena su kita ir bendroji savybė yra temperatūra.
Todėl šis principas, bet tiesiog teigia, kad jei kūnas A buvo pusiausvyroje su kūnu B, o šis kūnas B bus šiluminėje pusiausvyroje su kūnu C, tada kūnai A ir C taip pat bus pusiausvyroje terminis. Šis principas paaiškina faktą, kad du kūnai, esant skirtingai temperatūrai, gali keistis šiluma. Anksčiau ar vėliau abu kūnai pasiekia tą pačią temperatūrą, todėl yra visiškoje pusiausvyroje.
Pirmasis termodinamikos dėsnis
Kai kūnas yra kontakte su kūnu, kuris yra šaltesnis, įvyksta transformacija, kuri veda į pusiausvyros būseną. Ši pusiausvyros būsena yra pagrįsta tuo, kad dviejų kūnų temperatūra yra vienoda, nes šaltas kūnas sustiprina energijos perdavimą tarp karšto kūno. Norėdami paaiškinti šį reiškinį, mokslininkai padarė prielaidą, kad karšta medžiaga, esanti didesniais kiekiais, praleido šaltesnį kūną. Buvo galvojama apie skystį, kuris galėtų judėti per masę, kad galėtų keistis šiluma.
Šis principas yra atsakingas už šilumos, kaip energijos formos, nustatymą. Tai nėra materiali medžiaga. Tokiu būdu būtų galima parodyti, kad šiluma, matuojama kalorijomis, ir darbas, matuojama džauliais, yra lygiavertės. Todėl šiandien tai žinome 1 kalorija yra maždaug 4,186 džauliai.
Galima sakyti, kad pirmasis termodinamikos principas yra energijos išsaugojimo principas. Šilumos variklyje esantis energijos kiekis paverčiamas darbu ir jį gali pamatyti bet kuri mašina, galinti pagaminti tokį darbą be energijos vartojimo. Šį pirmąjį principą galime nustatyti taip: uždaros termodinaminės sistemos vidinės energijos kitimas yra lygus skirtumui, kuris egzistuoja tarp į sistemą tiekiamos šilumos ir minėtos sistemos darbo aplinkoje.
Antrasis termodinamikos dėsnis
Iš pradžių teigiama, kad neįmanoma pagaminti cikliškos mašinos, kurios rezultatas būtų tik šilumos perdavimas iš šalto kūno į šiltą kūną. Galime sakyti, kad neįmanoma, kad būtų galima atlikti pertvarką, kurios rezultatas bus tik kad paverstų iš vieno šaltinio šilumą mechaniniu darbu.
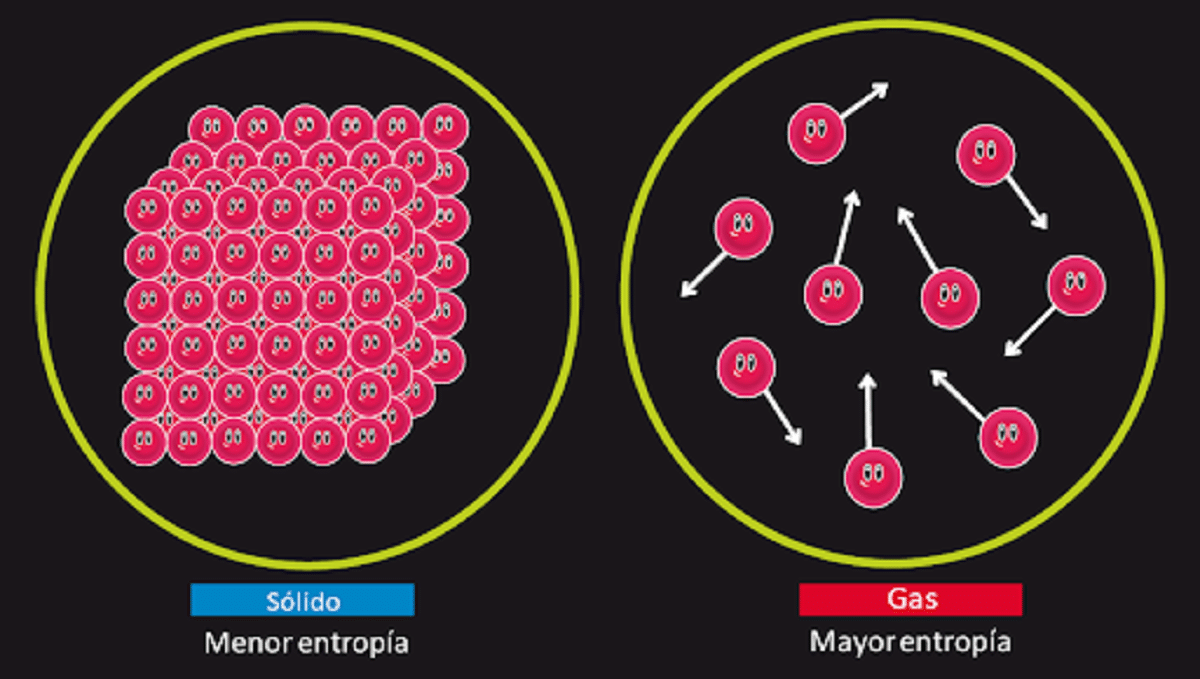
Šis principas yra atsakingas už galimybės paneigti, kad yra gerai žinomas amžinas antrosios rūšies judėjimas, neigimą. Mes žinome, kad entropija sistemos izoliacija lieka nepakitusi, kai vyksta grįžtama transformacija. Mes taip pat žinome, kad jis didėja, kai įvyksta negrįžtama transformacija.
Trečiasis termodinamikos dėsnis
Šis paskutinis principas yra glaudžiai susijęs su antruoju ir laikomas jo pasekme. Šis principas patvirtina, kad absoliučios būties neįmanoma pasiekti spalvotai su baigtiniu transformacijų skaičiumi. Mes žinome, kad absoliutus nulis yra ne didesnis nei minimali temperatūra, kurią galima pasiekti. Vienetais Kelvinas žinome, kad jis yra 0, tačiau Celsijaus laipsniais jis turi -273.15 laipsnių vertę.
Jame taip pat teigiama, kad kietos medžiagos, kuri yra idealiai kristalinė ir kurios temperatūra yra 0 kelvino, entropija lygi 0. Tai reiškia, kad entropijos nebūtų, taigi sistema būtų visiškai stabili. Ją sudarančių dalelių išsivadavimo, pasiskirstymo ir sukimosi energija 0 kelvino temperatūroje nebūtų nieko.
Tikiuosi, kad turėdami šią informaciją galite sužinoti daugiau apie termodinamiką ir pagrindinius principus.