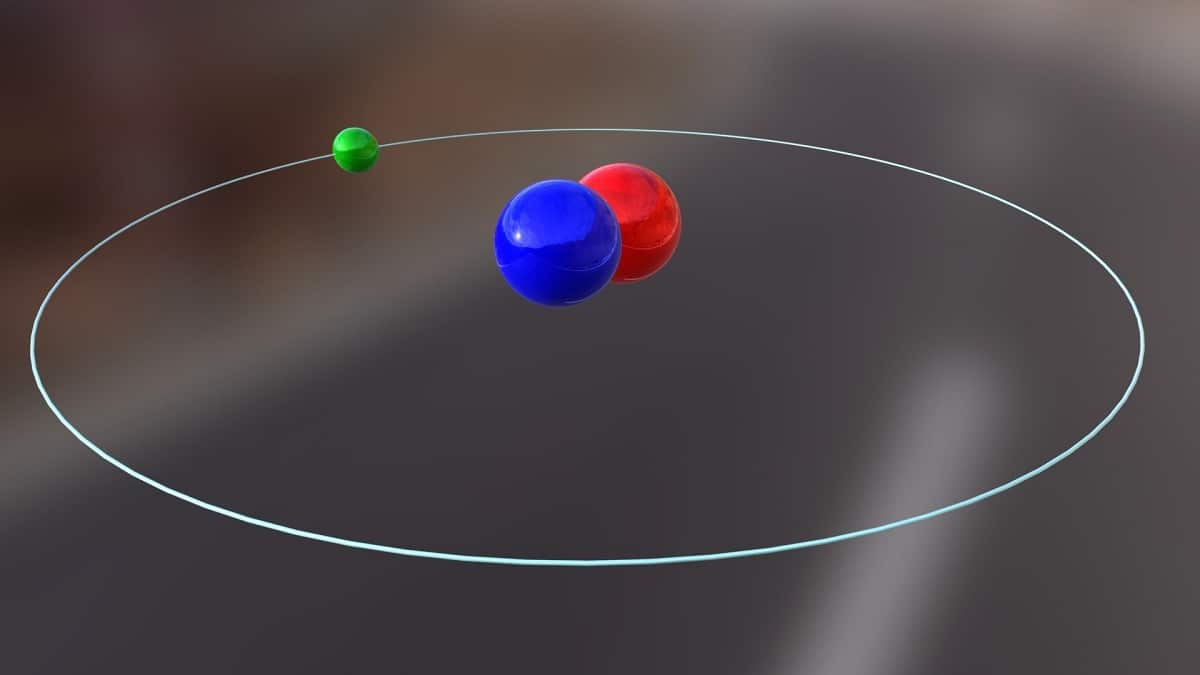
Šiandien mes kalbėsime apie izotopą, kuris naudojamas branduolinei energijai gaminti. Tai apie deuteris. Tai yra viena iš vandenilio izotopų rūšių ir ją žymi simbolis D arba 2H. Jis buvo pavadintas sunkiuoju vandeniliu, nes jo masė yra dvigubai didesnė nei protono. Izotopas yra ne kas kita, kaip rūšis, kilusi iš to paties cheminio elemento, tačiau turinti skirtingą masės skaičių. Deuteris naudojamas įvairiems tikslams.
Todėl šį straipsnį skirsime jums papasakoti apie visas deuterio savybes, struktūrą, savybes ir naudojimo būdus.
pagrindinės funkcijos
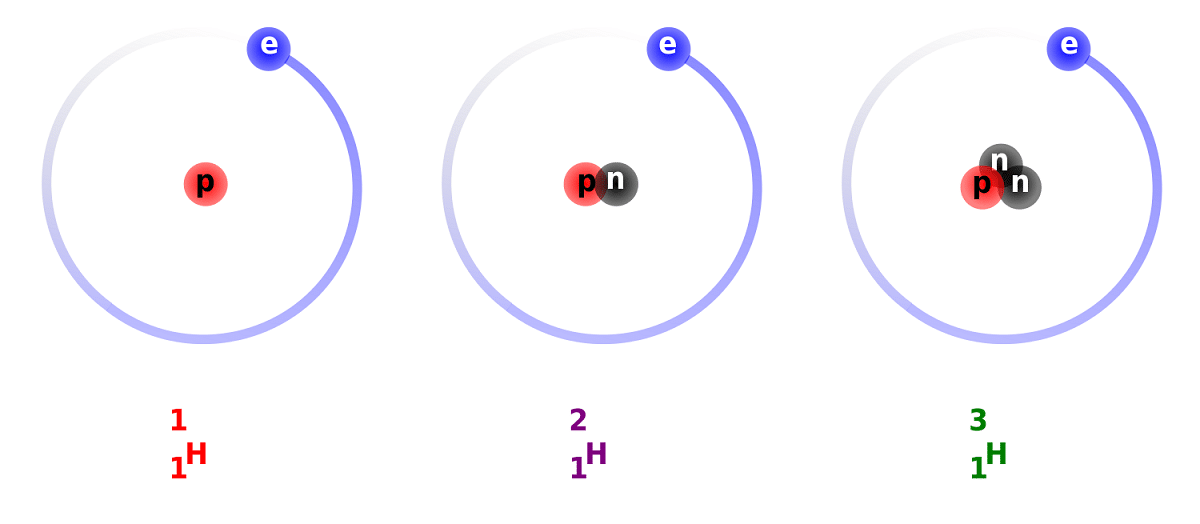
Skirtumas tarp deuterio ir vandenilio yra dėl jo turimų neutronų skaičiaus skirtumo. Dėl šios priežasties deuteris laikomas stabiliu izotopu ir jo galima rasti junginiuose, kuriuos sudaro visiškai natūralios kilmės vandenilis. Reikia nepamiršti, kad, nors jie yra natūralios kilmės, jų būna nedaug. Atsižvelgdamas į jo savybes, panašias į paprastą vandenilį, gali pakeisti ją visa reakcijose, kuriose dalyvauja. Tokiu būdu jis gali būti paverstas lygiavertėmis medžiagomis.
Dėl šios ir kitų priežasčių deuteris yra daugybė programų skirtingose mokslo srityse. Metams bėgant ji tapo vienu iš svarbiausių mokslinių tyrimų ir pažangos technologijų ir informacijos elementų.
Pagrindinę šio izotopo struktūrą sudaro branduolys, turintis protoną ir neutroną. Jo atominė masė yra maždaug 2,014 gramų. Šis izotopas buvo atrastas 1931 m. Iš JAV atvykusio chemiko Haroldo C. Urey ir jo bendradarbių Ferdinando Brickwedde'o ir George'o Murphy dėka. Pasirengimas sutikti deuterį grynoje būsenoje pirmą kartą sėkmingai įvyko 1933 m. Jau 50-aisiais pradėta naudoti kietą fazę, kuri demonstravo didelį stabilumą, vadinamą ličio deuteridu. Ši medžiaga gali pakeisti deuterį ir tritį daugelyje cheminių reakcijų.
Mokslo pažanga atsiranda, kai randama medžiaga, galinti palengvinti chemines reakcijas gaminant produktus. Šia prasme, jei ištyrėte šio izotopo gausą, kad galėtumėte stebėti tam tikrus dalykus. Buvo žinoma, kad deuterio dalis vandenyje šiek tiek skiriasi priklausomai nuo mėginio ploto. Yra keletas spektroskopijos tyrimų nustatė šio izotopo egzistavimą kitose mūsų galaktikos planetose. Tai gali būti labai svarbu tiriant kitų dangaus kūnų sudėtį.
Deuterio struktūra ir kilmė

Mes žinosime keletą faktų apie deuterį. Kaip jau minėjome anksčiau, pagrindinis skirtumas tarp vandenilio izotopų yra jų struktūra. Ar vandenilis, deuteris ir tritis turi skirtingą protonų ir neutronų kiekį, todėl jie turi skirtingas chemines savybes. Taip pat turiu nepamiršti, kad kitų žvaigždžių kūnuose esantis deuteris pašalinamas didesniu greičiu, nei atsirado. Tai yra viena iš priežasčių, kodėl taip sunku ištirti deuterio buvimą žvaigždžių kūnuose.
Manoma, kad kiti gamtos reiškiniai sudaro nedidelį kiekį deuterio, todėl jo gamyba ir šiandien kelia didelį susidomėjimą. Iš procentų, kurį jau minėjome apie deuterio buvimą gamtoje, jis nesudaro 0.02%. Atlikus mokslinius tyrimus paaiškėjo, kad didžioji dauguma iš deuterio susidariusių atomų natūraliai atsirado sprogimo, kuris sukėlė visatos, žinomos kaip Didžiojo sprogimo. Tai yra viena iš pagrindinių priežasčių, kodėl manoma, kad deuterio yra didelėse planetose, tokiose kaip Jupiteris.
Labiausiai paplitęs būdas natūraliai gauti šį izotopą yra tada, kai jie yra derinami su vandeniliu. Kai tai atsitiks, jis bus sujungtas protiumo forma. Mokslininkams įdomu žinoti santykį, nustatytą tarp deuterio ir vandenilio įvairiose mokslo srityse. Jis plačiai tiriamas tokiose mokslo šakose kaip astronomija ar klimatologija. Šiose šakose ji turi keletą praktinių paslaugų, skirtų pažinti ir suprasti visatą ir mūsų atmosferą.
Deuterio savybės

Mes sužinosime, kokios yra pagrindinės šio vandeniliui priklausančio izotopo savybės. Pirmiausia reikia žinoti, kas yra izotopas, neturintis radioaktyviųjų savybių. Tai reiškia, kad jis yra gana stabilaus pobūdžio. Jis gali būti naudojamas vandeniliui pakeisti įvairiose cheminėse reakcijose. Turėdamas didelį stabilumą natūraliai, rodo kitokį elgesį nei paprastas vandenilis. Tai atsitinka visose reakcijose, turinčiose biocheminį pobūdį. Prieš keičiant būtina žinoti, kad nors cheminėse reakcijose vandenilį galima pakeisti deuteriu, būtina žinoti, kad jie elgsis kitaip.
Pakeitus du vandenilio atomus vandenyje, galima gauti junginį, žinomą kaip sunkusis vanduo. Vandenilis, esantis vandenyne ir kuris yra deuterio pavidalu ji sudaro tik 0,016% proporcingumo dalį. Visatoje šis izotopas turi tendenciją greičiau susilieti, kad atsirastų helio. Derindami deuterį su atominiu deguonimi matome, kad jis tampa toksiška rūšimi. Nepaisant to ir cheminių savybių arba labai panašios į vandenilio savybes.
Kita šio izotopo savybė yra ta, kad kai deuterio atomai yra veikiami branduolio sintezės proceso aukštoje temperatūroje, gali išsiskirti didelis energijos kiekis. Tai yra egzodas, kurį jūs ištyrėte, kad galėtumėte implantuoti mūsų planetos branduolio sintezę. Kai kurios fizinės savybės, tokios kaip virimo temperatūra, garavimo šiluma, trigubas taškas ir tankis jų dydis didesnis nei vandenilio.
Tikiuosi, kad turėdami šią informaciją galite sužinoti daugiau apie deuterį ir jo savybes.