
ಪರಮಾಣು ವಸ್ತುವಿನ ಮೂಲ ಘಟಕವಾಗಿದೆ ಮತ್ತು ರಾಸಾಯನಿಕ ಅಂಶವನ್ನು ಗುರುತಿಸಬಲ್ಲ ಚಿಕ್ಕ ಭಾಗವಾಗಿದೆ. ಇದು ನ್ಯೂಟ್ರಾನ್ಗಳು ಮತ್ತು ಪ್ರೋಟಾನ್ಗಳನ್ನು ಒಳಗೊಂಡಿರುವ ಪರಮಾಣು ನ್ಯೂಕ್ಲಿಯಸ್ ಮತ್ತು ನ್ಯೂಕ್ಲಿಯಸ್ನ ಸುತ್ತಲಿನ ಎಲೆಕ್ಟ್ರಾನ್ಗಳನ್ನು ಒಳಗೊಂಡಿದೆ. ಪರಮಾಣು ಎಂಬ ಪದವು ಗ್ರೀಕ್ನಿಂದ ಬಂದಿದೆ ಮತ್ತು ಅವಿಭಾಜ್ಯ ಎಂದರ್ಥ. ಆದಾಗ್ಯೂ, ಅನೇಕರಿಗೆ ಸರಿಯಾಗಿ ತಿಳಿದಿಲ್ಲ ಪರಮಾಣು ಎಂದರೇನು ಅಥವಾ ಅದರ ಗುಣಲಕ್ಷಣಗಳೇನು.
ಆದ್ದರಿಂದ, ಪರಮಾಣು ಎಂದರೇನು, ಅದರ ಗುಣಲಕ್ಷಣಗಳು ಮತ್ತು ಪ್ರಾಮುಖ್ಯತೆಯನ್ನು ನಿಮಗೆ ತಿಳಿಸಲು ನಾವು ಈ ಲೇಖನವನ್ನು ಅರ್ಪಿಸಲಿದ್ದೇವೆ.
ಪರಮಾಣು ಎಂದರೇನು

ಪರಮಾಣುಗಳು ನ್ಯೂಕ್ಲಿಯಸ್ ಎಂದು ಕರೆಯಲ್ಪಡುವ ಕೇಂದ್ರ ಭಾಗವನ್ನು ಒಳಗೊಂಡಿರುತ್ತವೆ, ಇದರಲ್ಲಿ ಪ್ರೋಟಾನ್ಗಳು (ಧನಾತ್ಮಕವಾಗಿ ಚಾರ್ಜ್ಡ್ ಕಣಗಳು) ಮತ್ತು ನ್ಯೂಟ್ರಾನ್ಗಳು (ವಿದ್ಯುತ್ ತಟಸ್ಥ ಕಣಗಳು) ವಾಸಿಸುತ್ತವೆ. ನ್ಯೂಕ್ಲಿಯಸ್ನ ಸುತ್ತಲಿನ ಪ್ರದೇಶವು ಎಲೆಕ್ಟ್ರಾನ್ಗಳಿಂದ ಆಕ್ರಮಿಸಲ್ಪಡುತ್ತದೆ (ಋಣಾತ್ಮಕವಾಗಿ ಚಾರ್ಜ್ಡ್ ಕಣಗಳು); ಈ ಪ್ರದೇಶವನ್ನು ವಿದ್ಯುತ್ ಪದರ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಎಲೆಕ್ಟ್ರಿಕಲ್ ಶೆಲ್ (ಋಣಾತ್ಮಕ ಚಾರ್ಜ್ಡ್) ಮತ್ತು ಕೋರ್ (ಧನಾತ್ಮಕವಾಗಿ ಚಾರ್ಜ್ಡ್) ವಿದ್ಯುತ್ ಆಕರ್ಷಣೆಯಿಂದ ಒಟ್ಟಿಗೆ ಹಿಡಿದಿಟ್ಟುಕೊಳ್ಳುತ್ತದೆ.
ಪರಮಾಣುವಿನ ಸರಾಸರಿ ವ್ಯಾಸವು ಸುಮಾರು 10-10 ಮೀಟರ್, ಮತ್ತು ನ್ಯೂಕ್ಲಿಯಸ್ನ ಸರಾಸರಿ ವ್ಯಾಸವು ಸುಮಾರು 10-15 ಮೀಟರ್; ಆದ್ದರಿಂದ, ಪರಮಾಣುವಿನ ವ್ಯಾಸವು ಅದರ ನ್ಯೂಕ್ಲಿಯಸ್ಗಿಂತ 10.000 ರಿಂದ 100.000 ಪಟ್ಟು ಹೆಚ್ಚು. ಉದಾಹರಣೆಗೆ, ಒಂದು ಪರಮಾಣು ಫುಟ್ಬಾಲ್ ಮೈದಾನದ ಗಾತ್ರವಾಗಿದ್ದರೆ, ನ್ಯೂಕ್ಲಿಯಸ್ ಮೈದಾನದ ಮಧ್ಯದಲ್ಲಿರುವ ಚೆಂಡಿನ ಗಾತ್ರದಂತೆಯೇ ಇರುತ್ತದೆ. ಪರಮಾಣು 100 ಮೀಟರ್ ವ್ಯಾಸವನ್ನು ಹೊಂದಿದ್ದರೆ, ಅದರ ನ್ಯೂಕ್ಲಿಯಸ್ 1 ಸೆಂಟಿಮೀಟರ್ ವ್ಯಾಸವನ್ನು ಹೊಂದಿರುತ್ತದೆ.
ಕೆಲವು ಇತಿಹಾಸ

ಗ್ರೀಕ್ ತತ್ವಜ್ಞಾನಿ ಅರಿಸ್ಟಾಟಲ್ (384 BC - 322 BC) ಎಲ್ಲಾ ವಸ್ತುಗಳ ಸಂಯೋಜನೆಯನ್ನು ಅಂಶಗಳಿಂದ ವಿವರಿಸಲು ಪ್ರಯತ್ನಿಸಿದರು: ಭೂಮಿ, ಗಾಳಿ, ಬೆಂಕಿ ಮತ್ತು ನೀರು. ಡೆಮೋಕ್ರಿಟಸ್ (ಕ್ರಿ.ಪೂ. 546 - ಕ್ರಿ.ಪೂ. 460) ಒಬ್ಬ ಗ್ರೀಕ್ ವಿಜ್ಞಾನಿ ಮತ್ತು ಗಣಿತಶಾಸ್ತ್ರಜ್ಞರಾಗಿದ್ದು, ಕಣಗಳ ಗಾತ್ರಕ್ಕೆ ಮಿತಿ ಇದೆ ಎಂಬ ಕಲ್ಪನೆಯನ್ನು ಪ್ರಸ್ತಾಪಿಸಿದರು. ಈ ಕಣಗಳು ಎಷ್ಟು ಚಿಕ್ಕದಾಗುತ್ತವೆ ಎಂದರೆ ಅವುಗಳನ್ನು ಇನ್ನು ಮುಂದೆ ವಿಭಜಿಸಲು ಸಾಧ್ಯವಿಲ್ಲ ಎಂದು ಅವರು ಹೇಳಿದರು. ಅವರು ಅಂತಹ ಕಣಗಳನ್ನು "ಪರಮಾಣುಗಳು" ಎಂದು ಕರೆದರು.
XNUMX ನೇ ಶತಮಾನದ ಬಹುಪಾಲು, ಇದು ಪರಮಾಣು ಸಿದ್ಧಾಂತವನ್ನು ಪ್ರಸ್ತಾಪಿಸಿದ ಬ್ರಿಟಿಷ್ ವಿಜ್ಞಾನಿ ಡಾಲ್ಟನ್ ಅವರ ಪರಮಾಣು ಮಾದರಿಯಾಗಿದೆ, ಇದು ಆ ಸಮಯದಲ್ಲಿ ಪ್ರಾಚೀನರ ಚಿಂತನೆಯನ್ನು ಮೀರಿದೆ.
ಈ ಸಿದ್ಧಾಂತವು ಅದನ್ನು ಹೇಳುತ್ತದೆ ಎಲ್ಲಾ ವಸ್ತುವು ಪರಮಾಣುಗಳೆಂದು ಕರೆಯಲ್ಪಡುವ ಸಣ್ಣ ಅವಿಭಾಜ್ಯ ಕಣಗಳಿಂದ ಮಾಡಲ್ಪಟ್ಟಿದೆ. ಪರಮಾಣುಗಳು ಉಪಪರಮಾಣು ಕಣಗಳೆಂದು ಕರೆಯಲ್ಪಡುವ ಇತರ ಸಣ್ಣ ಕಣಗಳಿಂದ ಮಾಡಲ್ಪಟ್ಟಿದೆ ಎಂದು ಇತ್ತೀಚಿನ ಸಂಶೋಧನೆಯು ಕಂಡುಹಿಡಿದಿದೆ.
ಐತಿಹಾಸಿಕವಾಗಿ, ಪರಮಾಣು ರಚನೆಯ ಬಗ್ಗೆ ಪ್ರಸ್ತುತ ಜ್ಞಾನವನ್ನು ಪಡೆಯುವ ಮೊದಲು ವಸ್ತುವಿನ ಸಂಯೋಜನೆಯ ಮೇಲೆ ವಿಭಿನ್ನ ಪರಮಾಣು ಸಿದ್ಧಾಂತಗಳನ್ನು ಅಭಿವೃದ್ಧಿಪಡಿಸಲಾಗಿದೆ. ಪರಮಾಣು ಸಿದ್ಧಾಂತದ ಆಧಾರದ ಮೇಲೆ, ವಿಜ್ಞಾನಿಗಳು ಕ್ರಮೇಣ ವಿಕಾಸಗೊಳ್ಳುತ್ತಿರುವ ಪರಮಾಣುಗಳ ಮಾದರಿಗಳನ್ನು ಪ್ರದರ್ಶಿಸುತ್ತಿದ್ದಾರೆ.
ಜಾನ್ ಡಾಲ್ಟನ್ ಪ್ರಸ್ತಾಪಿಸಿದ ಮೊದಲ ಮಾದರಿಯು ನೀಲ್ಸ್ ಬೋರ್ ಅವರ ಪರಮಾಣುವಿನ ಮಾದರಿಯಾಗಿ ಅಭಿವೃದ್ಧಿಗೊಂಡಿತು. ಬೋರ್ ನ್ಯೂಕ್ಲಿಯಸ್ ಅನ್ನು ಸುತ್ತುವ ಎಲೆಕ್ಟ್ರಾನ್ಗಳ ಪ್ರಸ್ತುತ ಮಾದರಿಯನ್ನು ಹೋಲುವ ಮಾದರಿಯನ್ನು ಪ್ರಸ್ತಾಪಿಸಿದರು.
ಪರಮಾಣುವಿನ ರಚನೆ
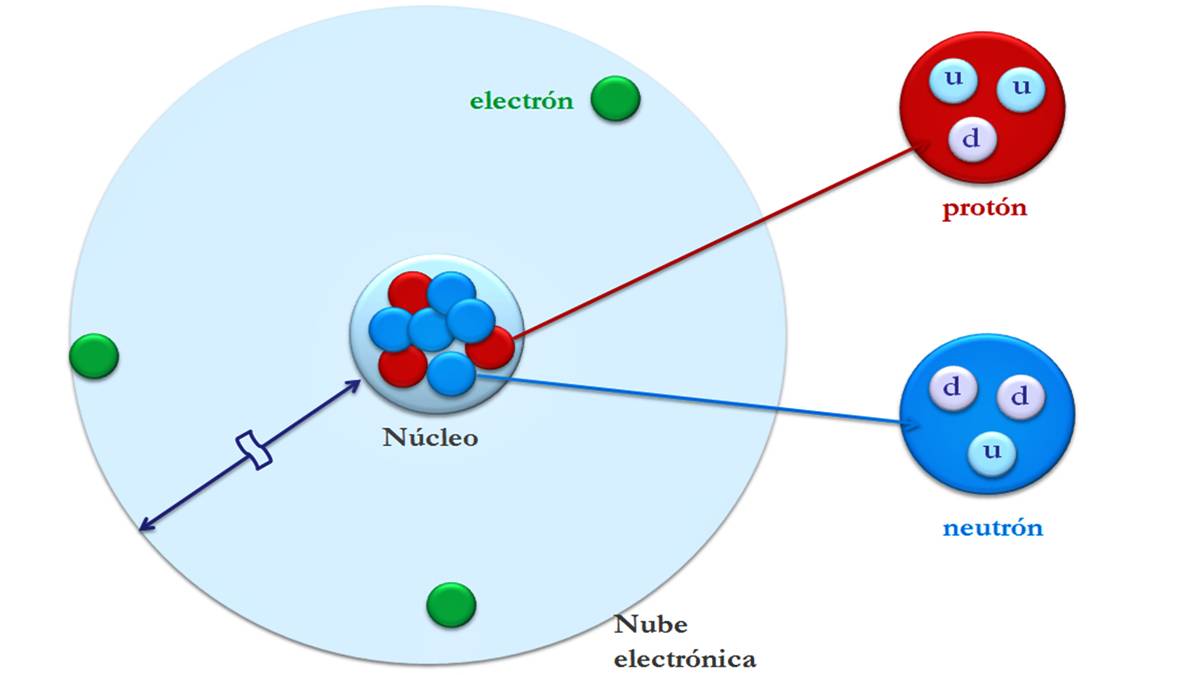
ಪರಮಾಣುಗಳು ಉಪಪರಮಾಣು ಕಣಗಳೆಂದು ಕರೆಯಲ್ಪಡುವ ಸಣ್ಣ ಕಣಗಳಿಂದ ಮಾಡಲ್ಪಟ್ಟಿದೆ: ಎಲೆಕ್ಟ್ರಾನ್ಗಳು, ಪ್ರೋಟಾನ್ಗಳು ಮತ್ತು ನ್ಯೂಟ್ರಾನ್ಗಳು. ಪರಮಾಣುವಿನ ಹೆಚ್ಚಿನ ದ್ರವ್ಯರಾಶಿಯು ನ್ಯೂಕ್ಲಿಯಸ್ನಲ್ಲಿ ಕೇಂದ್ರೀಕೃತವಾಗಿರುತ್ತದೆ. ಮತ್ತು ಅದರ ದೊಡ್ಡ ಪರಿಮಾಣವು ಎಲೆಕ್ಟ್ರಾನ್ಗಳು ಕಂಡುಬರುವ ವಿದ್ಯುತ್ ಶೆಲ್ನಲ್ಲಿದೆ.
ಎಲೆಕ್ಟ್ರಾನ್ಗಳು, ಪ್ರೋಟಾನ್ಗಳು ಮತ್ತು ನ್ಯೂಟ್ರಾನ್ಗಳು
ಎಲೆಕ್ಟ್ರಾನ್ಗಳು ಋಣಾತ್ಮಕವಾಗಿ ಚಾರ್ಜ್ ಆಗುತ್ತವೆ ಮತ್ತು ಬಹುತೇಕ ದ್ರವ್ಯರಾಶಿಯನ್ನು ಹೊಂದಿರುವುದಿಲ್ಲ. ಇದರ ದ್ರವ್ಯರಾಶಿಯು ಪರಮಾಣು ನ್ಯೂಕ್ಲಿಯಸ್ಗಿಂತ ಸುಮಾರು 1840 ಪಟ್ಟು ಹೆಚ್ಚು.. ಅವು ಪರಮಾಣುವಿನ ಕೇಂದ್ರ ನ್ಯೂಕ್ಲಿಯಸ್ನ ಸುತ್ತ ಸುತ್ತುವ ಸಣ್ಣ ಕಣಗಳಾಗಿವೆ. ಜೊತೆಗೆ, ಅವರು ವಿದ್ಯುತ್ಕಾಂತೀಯ ಕ್ಷೇತ್ರವನ್ನು ಉತ್ಪಾದಿಸುವ ನ್ಯೂಕ್ಲಿಯಸ್ ಸುತ್ತಲೂ ವೇಗವಾಗಿ ಚಲಿಸುತ್ತಾರೆ.
ಪ್ರೋಟಾನ್ ಸಂಪೂರ್ಣ ಮೌಲ್ಯದಲ್ಲಿ ಎಲೆಕ್ಟ್ರಾನ್ನ ಮೇಲಿನ ಚಾರ್ಜ್ನಂತೆಯೇ ಅದೇ ಧನಾತ್ಮಕ ಚಾರ್ಜ್ ಅನ್ನು ಹೊಂದಿರುತ್ತದೆ, ಆದ್ದರಿಂದ ಪ್ರೋಟಾನ್ಗಳು ಮತ್ತು ಎಲೆಕ್ಟ್ರಾನ್ಗಳು ಪರಸ್ಪರ ಆಕರ್ಷಿಸುತ್ತವೆ. ಇವುಗಳು ದ್ರವ್ಯರಾಶಿಯ ಘಟಕವನ್ನು ರೂಪಿಸುತ್ತವೆ ಮತ್ತು ನ್ಯೂಟ್ರಾನ್ಗಳೊಂದಿಗೆ ಪರಮಾಣುವಿನ ನ್ಯೂಕ್ಲಿಯಸ್ ಅನ್ನು ರೂಪಿಸುತ್ತವೆ.
ನ್ಯೂಟ್ರಾನ್ಗಳಿಗೆ ಯಾವುದೇ ಚಾರ್ಜ್ ಇಲ್ಲ, ಅಂದರೆ ಅವು ತಟಸ್ಥ ಚಾರ್ಜ್ ಹೊಂದಿರುತ್ತವೆ. ಪ್ರೋಟಾನ್ಗಳ ಜೊತೆಗೆ, ಇದು ನ್ಯೂಕ್ಲಿಯಸ್ ಅನ್ನು ರೂಪಿಸುತ್ತದೆ ಮತ್ತು ಪರಮಾಣುವಿನ ಬಹುತೇಕ ಎಲ್ಲಾ ದ್ರವ್ಯರಾಶಿಯನ್ನು (99,9%) ಪ್ರತಿನಿಧಿಸುತ್ತದೆ. ನ್ಯೂಟ್ರಾನ್ಗಳು ನ್ಯೂಕ್ಲಿಯಸ್ಗೆ ಸ್ಥಿರತೆಯನ್ನು ಒದಗಿಸುತ್ತವೆ.
ಪರಮಾಣುಗಳು ಶಕ್ತಿಯ ಮಟ್ಟವನ್ನು ಹೊಂದಿವೆ, ನ್ಯೂಕ್ಲಿಯಸ್ ಸುತ್ತ ಏಳು ಶೆಲ್ಗಳು ನ್ಯೂಕ್ಲಿಯಸ್ ಅನ್ನು ಸುತ್ತುವ ಎಲೆಕ್ಟ್ರಾನ್ಗಳಿವೆ. ಚಿಪ್ಪುಗಳನ್ನು K, L, M, N, O, P, ಮತ್ತು Q ಎಂದು ಹೆಸರಿಸಲಾಗಿದೆ. ಪ್ರತಿ ಶೆಲ್ ಸೀಮಿತ ಸಂಖ್ಯೆಯ ಎಲೆಕ್ಟ್ರಾನ್ಗಳನ್ನು ಹಿಡಿದಿಟ್ಟುಕೊಳ್ಳುತ್ತದೆ: ಪ್ರತಿ ಶೆಲ್ಗೆ ಎಂಟು ಎಲೆಕ್ಟ್ರಾನ್ಗಳು. ಹೊರಗಿನ ಪದರವು ಯಾವಾಗಲೂ ಅತ್ಯಂತ ಕ್ರಿಯಾತ್ಮಕವಾಗಿರುತ್ತದೆ. ಹೈಡ್ರೋಜನ್ ಪರಮಾಣು ಮಾತ್ರ ನ್ಯೂಟ್ರಾನ್ಗಳನ್ನು ಹೊಂದಿರುವುದಿಲ್ಲ ಮತ್ತು ಪ್ರೋಟಾನ್ ಸುತ್ತಲೂ ಕೇವಲ ಒಂದು ಎಲೆಕ್ಟ್ರಾನ್ ಪರಿಭ್ರಮಿಸುತ್ತದೆ.
ರಾಸಾಯನಿಕ ಗುಣಲಕ್ಷಣಗಳು
ರಸಾಯನಶಾಸ್ತ್ರದಲ್ಲಿ, ಪರಮಾಣುಗಳು ಮೂಲಭೂತ ಘಟಕಗಳಾಗಿವೆ, ಅದು ಸಾಮಾನ್ಯವಾಗಿ ಪ್ರತಿ ಪ್ರತಿಕ್ರಿಯೆಯಲ್ಲಿ ತಮ್ಮ ಮೂಲ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಉಳಿಸಿಕೊಳ್ಳುತ್ತದೆ. ಅವುಗಳನ್ನು ನಾಶಪಡಿಸಲಾಗಿಲ್ಲ ಅಥವಾ ರಚಿಸಲಾಗಿಲ್ಲ, ಅವುಗಳ ನಡುವೆ ವಿಭಿನ್ನ ಸಂಪರ್ಕಗಳೊಂದಿಗೆ ವಿಭಿನ್ನ ರೀತಿಯಲ್ಲಿ ಸರಳವಾಗಿ ಜೋಡಿಸಲಾಗುತ್ತದೆ.
ಅಣುಗಳು ಮತ್ತು ಇತರ ರೀತಿಯ ವಸ್ತುಗಳನ್ನು ರಚಿಸಲು ಪರಮಾಣುಗಳು ಒಟ್ಟಿಗೆ ಸೇರಿಕೊಳ್ಳುತ್ತವೆ. ರಾಸಾಯನಿಕ ಕ್ರಿಯೆಗಳಲ್ಲಿ ರಚಿಸಲಾದ ಬಂಧಗಳು ವಿಭಿನ್ನ ರಾಸಾಯನಿಕ ಅಂಶಗಳನ್ನು ಪ್ರತ್ಯೇಕಿಸುವ ಒಂದು ನಿರ್ದಿಷ್ಟ ಸಂಯೋಜನೆಯನ್ನು ಹೊಂದಿವೆ. ಈ ಅಂಶಗಳು ಅಂಶಗಳ ಆವರ್ತಕ ಕೋಷ್ಟಕದಲ್ಲಿ ಕಂಡುಬರುವವುಗಳಾಗಿವೆ.
ಈ ಪ್ರತಿಯೊಂದು ಅಂಶವು ನ್ಯೂಕ್ಲಿಯಸ್ನಲ್ಲಿ ಅನೇಕ ಪ್ರೋಟಾನ್ಗಳನ್ನು ಹೊಂದಿದೆ. ಈ ಸಂಖ್ಯೆಯನ್ನು ಪರಮಾಣು ಸಂಖ್ಯೆ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ ಮತ್ತು ಇದನ್ನು Z ಅಕ್ಷರದಿಂದ ಸೂಚಿಸಲಾಗುತ್ತದೆ. ಒಂದೇ ಸಂಖ್ಯೆಯ ಪ್ರೋಟಾನ್ಗಳನ್ನು ಹೊಂದಿರುವ ಎಲ್ಲಾ ಪರಮಾಣುಗಳು ಒಂದೇ ಅಂಶಕ್ಕೆ ಸೇರಿವೆ ಮತ್ತು ಅವು ವಿಭಿನ್ನ ರಾಸಾಯನಿಕ ಅಂಶಗಳಾಗಿದ್ದರೂ ಒಂದೇ ರಾಸಾಯನಿಕ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಹೊಂದಿವೆ.
ಮತ್ತೊಂದೆಡೆ, A ಅಕ್ಷರದಿಂದ ಸೂಚಿಸಲಾದ ಸಮೂಹ ಸಂಖ್ಯೆಯನ್ನು ನಾವು ಕಂಡುಕೊಳ್ಳುತ್ತೇವೆ. ಈ ಸಂಖ್ಯೆಯು ಪರಮಾಣುವಿನಲ್ಲಿ ಇರುವ ನ್ಯೂಕ್ಲಿಯೋನ್ಗಳ ಸಂಖ್ಯೆಯನ್ನು ಸೂಚಿಸುತ್ತದೆ. ನಾವು ಕಂಡುಕೊಳ್ಳಬಹುದಾದ ಮತ್ತೊಂದು ರೀತಿಯ ಪರಮಾಣು ಮತ್ತು ಅದರ ಬಗ್ಗೆ ನಮಗೆ ಚೆನ್ನಾಗಿ ತಿಳಿದಿರುವುದು ಐಸೊಟೋಪ್. ಈ ಪರಮಾಣುಗಳು ಒಂದೇ ಸಂಖ್ಯೆಯ ಪ್ರೋಟಾನ್ಗಳನ್ನು ಹೊಂದಿರುತ್ತವೆ ಆದರೆ ವಿಭಿನ್ನ ಸಂಖ್ಯೆಯ ನ್ಯೂಟ್ರಾನ್ಗಳನ್ನು ಹೊಂದಿರುತ್ತವೆ. ಅವುಗಳ ಭೌತಿಕ ಗುಣಲಕ್ಷಣಗಳು ಒಂದಕ್ಕೊಂದು ಭಿನ್ನವಾಗಿದ್ದರೂ ಅವು ಒಂದೇ ರಾಸಾಯನಿಕ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಹೊಂದಿವೆ.
ನಾವು ಮೊದಲೇ ಗಮನಿಸಿದಂತೆ, ಐಸೊಟೋಪ್ಗಳು ಬಹಳ ಮುಖ್ಯ. ಮತ್ತು ಅವು ಪರಮಾಣು ಶಕ್ತಿಗೆ ಪ್ರಮುಖವಾಗಿವೆ ಏಕೆಂದರೆ ಯುರೇನಿಯಂ ಪುಷ್ಟೀಕರಣವು ಒಂದು ಯುರೇನಿಯಂ ಐಸೊಟೋಪ್ ಅನ್ನು ಹೆಚ್ಚು ಅಸ್ಥಿರವಾದ ರಾಸಾಯನಿಕ ರಚನೆಯೊಂದಿಗೆ ಇನ್ನೊಂದಕ್ಕೆ ಪರಿವರ್ತಿಸುವುದನ್ನು ಒಳಗೊಂಡಿರುತ್ತದೆ, ಇದು ನಮಗೆ ಸರಣಿ ಕ್ರಿಯೆಯನ್ನು ಹೊಂದಲು ಅನುವು ಮಾಡಿಕೊಡುತ್ತದೆ.
ಪ್ರಯೋಜನಗಳು
ಪರಮಾಣುವನ್ನು ವ್ಯಾಖ್ಯಾನಿಸುವ ಗುಣಲಕ್ಷಣಗಳು:
- ಪರಮಾಣು ಸಂಖ್ಯೆ (Z) ನ್ಯೂಕ್ಲಿಯಸ್ನಲ್ಲಿರುವ ಪ್ರೋಟಾನ್ಗಳ ಸಂಖ್ಯೆಯನ್ನು ಸೂಚಿಸುತ್ತದೆ. ಒಂದೇ ಸಂಖ್ಯೆಯ ಪ್ರೋಟಾನ್ಗಳನ್ನು ಹೊಂದಿರುವ ಎಲ್ಲಾ ಪರಮಾಣುಗಳು ಒಂದೇ ಅಂಶಕ್ಕೆ ಸೇರಿವೆ. ಉದಾಹರಣೆಗೆ, ಕೇವಲ ಒಂದು ಪ್ರೋಟಾನ್ ಹೊಂದಿರುವ ಹೈಡ್ರೋಜನ್ ಪರಮಾಣು.
- ದ್ರವ್ಯರಾಶಿ ಸಂಖ್ಯೆ ಪ್ರೋಟಾನ್ಗಳು ಮತ್ತು ನ್ಯೂಟ್ರಾನ್ಗಳ ಮೊತ್ತವನ್ನು ಸೂಚಿಸುತ್ತದೆ.. ವಿಭಿನ್ನ ಸಂಖ್ಯೆಯ ನ್ಯೂಟ್ರಾನ್ಗಳನ್ನು ಹೊಂದಿರುವ ಅಂಶಗಳು ಒಂದೇ ಅಂಶದ ವಿಭಿನ್ನ ಐಸೊಟೋಪ್ಗಳಾಗಿವೆ.
- ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿ ಇದು ರಾಸಾಯನಿಕ ಬಂಧಗಳನ್ನು ರೂಪಿಸಿದಾಗ ಎಲೆಕ್ಟ್ರಾನ್ಗಳನ್ನು ಆಕರ್ಷಿಸುವ ಪರಮಾಣುಗಳ ಪ್ರವೃತ್ತಿಯಾಗಿದೆ.
- ಪರಮಾಣು ತ್ರಿಜ್ಯ ಇದು ಒಂದೇ ಅಂಶದ ಎರಡು ಸೇರಿಕೊಂಡ ನ್ಯೂಕ್ಲಿಯಸ್ಗಳ ನಡುವಿನ ಅರ್ಧದಷ್ಟು ಅಂತರಕ್ಕೆ ಅನುರೂಪವಾಗಿದೆ.
- ಅಯಾನೀಕರಣ ಸಾಮರ್ಥ್ಯ ಇದು ಒಂದು ಅಂಶದಿಂದ ಎಲೆಕ್ಟ್ರಾನ್ ಅನ್ನು ತೆಗೆದುಹಾಕಲು ಅಗತ್ಯವಾದ ಶಕ್ತಿಯಾಗಿದೆ.
ಈ ಮಾಹಿತಿಯೊಂದಿಗೆ ನೀವು ಪರಮಾಣು ಮತ್ತು ಅದರ ಗುಣಲಕ್ಷಣಗಳ ಬಗ್ಗೆ ಇನ್ನಷ್ಟು ತಿಳಿದುಕೊಳ್ಳಬಹುದು ಎಂದು ನಾನು ಭಾವಿಸುತ್ತೇನೆ.
ತುಂಬಾ ಒಳ್ಳೆಯದು
ರಿಕಾರ್ಡೊ