
ג'ון דלטון הוא פיזיקאי, כימאי ומטאורולוג אנגלי שחולל שינוי בעולם המדע בזכות שילוב תאוריית האטום המודרנית. תיאוריה זו מכונה מודל אטומי של הדלתון וזה היה די רלוונטי. ג'ון דלטון ידוע גם במחקריו על חוסר היכולת להבחין בצבעים בעין האנושית. כך אנו מכירים את הנכות הזו כעיוורון צבעים.
במאמר זה אנו נספר לכם על כל המאפיינים והחשיבות שהיה למודל האטומי של דלתון למדע.
הסיפור הקטן של דלתון

כדי להציג את המודל האטומי של דלתון, בואו נסקור תחילה את ההיסטוריה של מדען זה. וזה שרעיון האטום התחיל אצל הפילוסוף היווני דמוקריטוס. עם זאת, תיאוריה זו לא התקבלה באופן נרחב ואפילו מדענים רבים מצאו אותה מגוחכת במשך מאות ומאות שנים. מאז האטומיזם הזה וכל הזרמים הפילוסופיים היוונים שהיו קיימים, עברו יותר מ -2 שנה לתיאוריה אטומית אחרת להיות בעלי רלוונטיות כזו בעולם המדעי. עם זאת, בשנת 1804, ג'ון דלטון, זה התבסס על רעיונותיהם של האטומיסטים להצליח להציג את המודל האטומי של דלתון.
המודל שלו היה תוצאה של המסקנות שהסיק מניסויים שונים שבוצעו בסוגים שונים של גזים. בהתבסס על תוצאות חקירות אלה ניתן היה להראות כי אטומים קיימים באמת. דמוקריטוס לא ציין שהאטום קיים כפי שהוא. בדרך זו נוצרה אחת התיאוריות החשובות בתולדות הפיזיקה המודרנית.
לאחר מכן נתאר את העקרונות הבסיסיים של המודל האטומי של דלתון.
עקרונות בסיסיים של המודל האטומי של אלטו
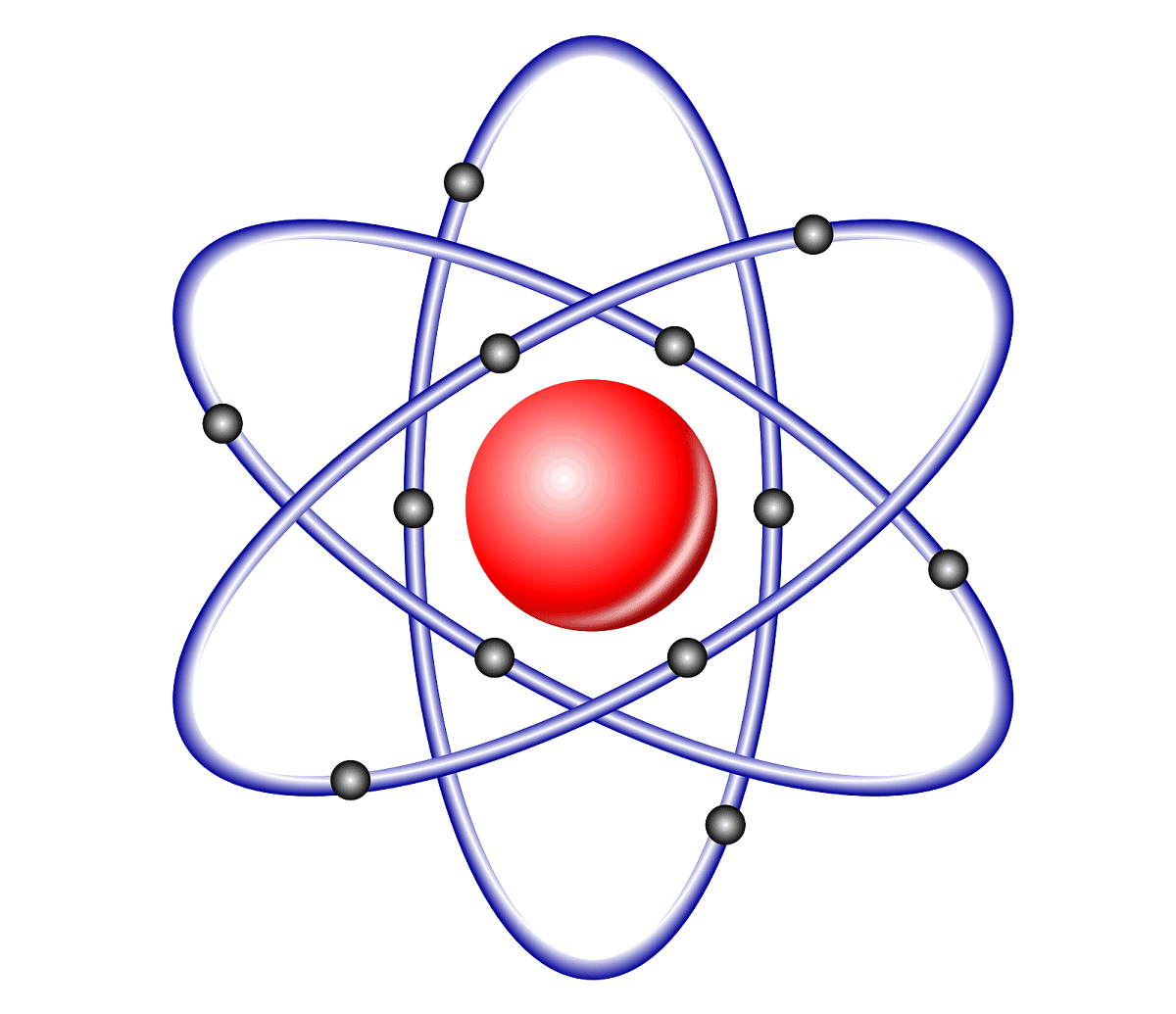
- כל החומר עשוי מאטומים. המשמעות היא שכל מה שאנחנו מכירים ומוחשי מורכב מאטומים הן על הפלנטה שלנו והן משאר היקום הידוע. כל האלמנטים עשויים גם מאטומים.
- אטומים אינם ניתנים לחלוקה ובלתי ניתנים להריסה. דלתון האמין כי אטומים הם חלקיקים בגודל קטן יותר מחומר ובלתי ניתנים להריסה כימית.
- כל האטומים של יסוד זהים. עלינו לדעת כי כל האטומים המרכיבים סוג של יסוד הם בעלי מסה זהה ואותם מאפיינים. יש להם גם אותה מורפולוגיה ונעים באותה מהירות.
- אטומים של אלמנטים שונים משתנים במסה ובתכונות. זה מה שעושה כל פריט שונה מהשני. מכיוון שכל האלמנטים מורכבים מאטומים, אטומים אלה הם בעלי מאפיינים ומסות שונים.
- תרכובות מורכבות משילוב של שני אטומים שונים או יותר. קביעה זו של תרכובות היא שגורמת לשונות רבה יותר ביסודות. וזה שלמרות שהתרכובת כוללת את אותם סוגים של אטומים, הם משולבים ובאותם הפרופורציות.
- תגובה כימית היא סידור מחדש של אטומים. כאשר מתרחשת תגובה כימית אין מדובר בהפרדה, איחוד או סידור מחדש של אטומים. אנחנו לא מדברים על אטומים שמשנים את המאפיינים או המסה שלהם. האטומים של יסוד אחד לעולם אינם משתנים לאטומים של יסוד אחר כתוצאה מתגובה כימית קשה. פשוט שנה את הארגון שלך.
שיקולים נוספים למודל האטומי של דלתון
לאחר שתוארו עקרונות המודל, היה צורך לבצע שיקולים נוספים שיכולים להשלים את כל המאפיינים של המודל האמור. בנוסף לעקרונות אלה ג'ון דלטון הציע זאת אטומי היסודות המתקשרים זה עם זה ליצירת מולקולות מצייתים לחוק שימור המסה. המשמעות היא שכמות וסוג התנוחה שיש למולקולה שווה למספר ולסוג האטום של המוצרים ששימשו בתגובה הכימית. זה גם מציית לחוק שאומר שהחומר לא נוצר ולא נהרס, אלא הוא הופך.
היבט חשוב נוסף במודל האטומי של דלתון היה חוק הפרופורציות המרובות. חוק זה אומר לנו שאם אנו משלבים את האטומים של שני יסודות, אטומים אלה יכולים לשלב רק ביחס למספרים שלמים. במילים אחרות, ניתן לשלב אטום כאטום אחר, שני אטומים עם אטום אחד, שני אטומים עם שני אטומים אחרים וכו '. דוגמה המסייעת לנו להבין את חוק הפרופורציות המרובות היא הבאה: אנו לוקחים את המים ומשלבים אותם ביחס של 2 ל 1. פירוש הדבר שלמים יש שני אטומי מימן לכל אחד מחמצן. לכן, לא ניתן להשתמש באף פרופורציה שהיה ביסודות אלה להפקת מים. כלומר, איננו יכולים לייצר מים אם אנו משתמשים ב -3 אטומי מימן ו -2 אטומי חמצן.
להיות מסוגל לתת מאפיינים לאטומי דלתון יצר את טבלת המשקולות האטומיים. טבלה זו הייתה שימושית למדי מכיוון שהיא הכילה את כל האלמנטים בסדר מסוים בהתבסס על משקלם. כל האלמנטים בטבלה הושוו עם מימן, וזה הקל מכולם. לכן, מימן הוא מספר אחד בטבלה ויש לו את המספר האטומי 1.
קבלת המודל האטומי של דלתון ומגבלותיו
מכיוון שמודלים אלה שברו את התוכניות שעד אז הוקמו, האישור היה מורכב יותר. עם זאת, המודל האטומי של דלתון התקבל על ידי מדענים רבים באותה תקופה כמעט מיד. הודות למודל אטומי זה יש לנו רבים מבסיסי התיאוריה הנוכחית.
המדענים של ימינו יודעים שיש באטומים כמה סוגים של חלקיקים קטנים יותר כמו פרוטונים, נויטרונים ואלקטרונים. תאוריית דלתון זו הפכה לבסיס לתורת הכימיה.
לבעיה במודל אטומי זה היו גם כמה טעויות ומגבלות. וזה שדלתון חשב שהאטומים של כל היסודות היו מסוגלים להישאר בנפרד, ולכן הוא לא יכול היה להבין שבאלמנטים מסוימים האטומים קיימים ויוצרים מולקולות, כמו למשל בחמצן טהור. חמצן טהור מורכב משני אטומי חמצן. כלומר, זו מולקולה מאותו יסוד אך יש לה שני אטומי חמצן.
אחת השגיאות העיקריות במודל זה היא שחשבו שהמתחם הפשוט ביותר בין שני יסודות הוא תמיד אטום של כל יסוד. זה גרם לו להסיק שהמים הם HO ולא H2O.
עם זאת, המודל האטומי של דלתון קידם לא מעט את עולם הכימיה והפיזיקה. אני מקווה שעם מידע זה תוכלו ללמוד עוד על המודל האטומי של דלתון.
