
Voda je najdragocjeniji resurs čovjeka i svih živih bića na planeti. Ovaj resurs je element koji može prirodno biti u različitim stanjima. The vodena stanja Oni su vrlo važni u hidrološkom ciklusu za uspostavljanje univerzalnog kontinuiranog toka.
Iz tog razloga, ovaj ćemo članak posvetiti tome da vam kažemo koja su glavna stanja vode, koja su njihova svojstva i važnost svakog od njih.
vodena stanja
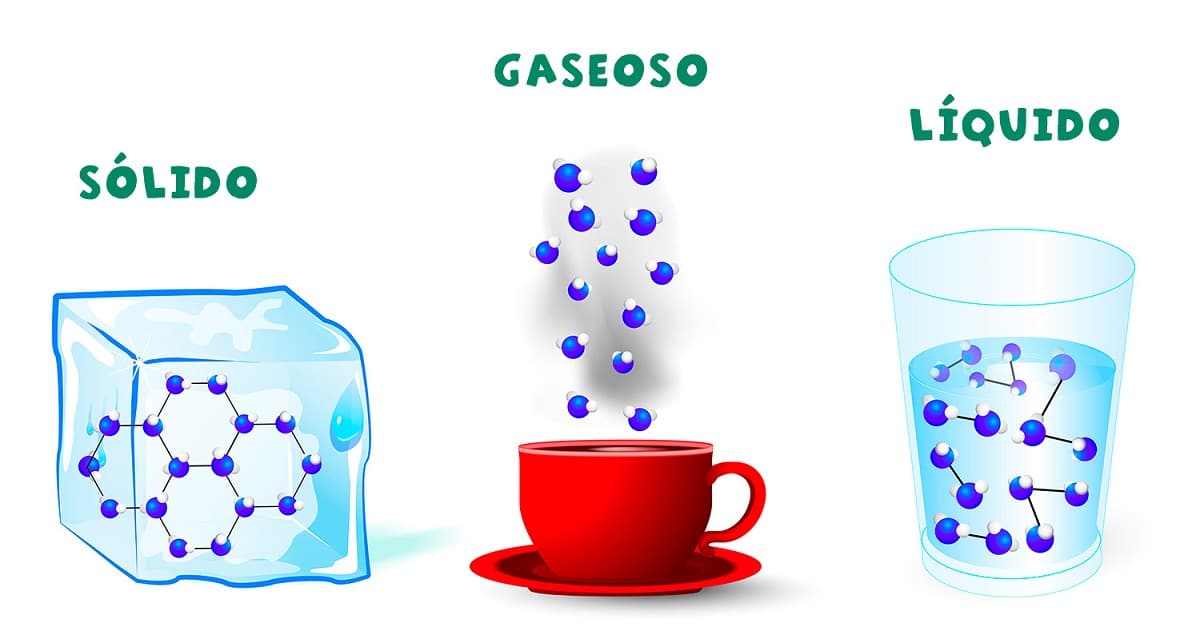
Svi znamo što je voda i znamo njena tri oblika, poznata kao njena fizikalna stanja: tekuće (voda), čvrsto (led) i plinovito (para). Ovo su tri oblika u kojima se voda može naći u prirodi a da nimalo ne promijeni svoj kemijski sastav: H2O (vodik i kisik).
Stanje vode ovisi o pritisku koji je okružuje i temperaturi kojoj je izložena, odnosno uvjetima okoline. Stoga se manipuliranjem ovim uvjetima tekuća voda može pretvoriti u kruto ili plinovito stanje i obrnuto.
S obzirom na važnost vode za život i njeno obilje na Zemlji, vaše fizičko stanje koristi se kao referenca u mnogim mjernim sustavima te se stoga može usporediti s drugim materijalima i tvarima.
svojstva vode

Zbog površinske napetosti, kukci i pauci se mogu kretati u vodi. Voda je tvar bez mirisa, boje i okusa s neutralnim pH (7, nije ni kisela ni alkalna). Sastoji se od dva atoma vodika i jednog atoma kisika u svakoj molekuli.
Njegove čestice imaju ogromne kohezijske sile koje ih drže zajedno, tako da ima značajnu površinsku napetost (koju neki kukci koriste za "hod" po vodi) i zahtijeva puno energije da promijeni svoje fizičko stanje.
Voda je poznata kao "univerzalno otapalo" jer može otopiti više tvari nego bilo koja druga tekućina. Osim toga, esencijalni je spoj života i prisutan je u velikim količinama u svim živim organizmima. Voda pokriva dvije trećine ukupne površine našeg planeta.
Različita stanja vode i njihove karakteristike
tekući
U tekućem stanju voda je tekuća i savitljiva. Stanje s kojim nas najviše povezujemo je tekućina, koja je najgušće i najnerazumljivije stanje, a najviše ga ima na našem planetu. U svom tekućem stanju, čestice vode su blizu, ali ne preblizu. Stoga tekuća voda ima fleksibilnost i fluidnost tekućina, ali gubi svoj oblik da bi poprimila oblik posude u kojoj se nalazi.
Stoga tekuća voda zahtijeva određene uvjete energije (toplina, temperatura) i tlaka. Voda je tekućina na temperaturama između 0 i 100º C i normalnom atmosferskom tlaku. Međutim, ako se podvrgne višim pritiscima (pregrijana voda), može prijeći točku vrenja i u tekućem stanju može dosegnuti kritičnu temperaturu od 374°C, najvišu temperaturu na kojoj se plin može ukapljiti. Tekuća voda se obično nalazi u oceanima, jezerima, rijekama i podzemnim sedimentima, ali se nalazi i unutar živih organizama.
Kruto stanje
Čvrsto stanje vode, često nazivano ledom, To se postiže smanjenjem njegove temperature na 0°C ili manje. Jedna od neobičnosti smrznute vode je da dodaje volumen u usporedbi s tekućim oblikom. To jest, led je manje gustoće od vode (zbog čega led pluta).
Izgled leda je tvrd, krt i proziran, a varira od bijele do plave, ovisno o čistoći i debljini sloja. Pod nekim uvjetima, može privremeno ostati u polučvrstom stanju koje se naziva snijeg.
Čvrsta voda se obično nalazi u ledenjacima, planinskim vrhovima, permafrostu (permafrostu) i vanjskim planetima Sunčevog sustava te u našim zamrzivačima hrane.
Plinoviti
Plinovito stanje vode, poznato kao para ili vodena para, to je uobičajena komponenta naše atmosfere i čak je prisutna u svakom našem udahu. Pri niskom tlaku ili visokoj temperaturi voda isparava i nastoji se podići jer je vodena para manje gustoće od zraka.
Sve dok se nalazimo na razini mora (1 atmosfera), prijelaz u plinovito stanje događa se na 100°C. Plinovita voda tvori oblake koje vidimo na nebu, nalazi se u zraku koji udišemo (osobito izdisajem) i u magli koja se pojavljuje za hladnih, vlažnih dana. Ako lonac s vodom stavimo kuhati, također ga možemo vidjeti.
Promjene u stanju vode
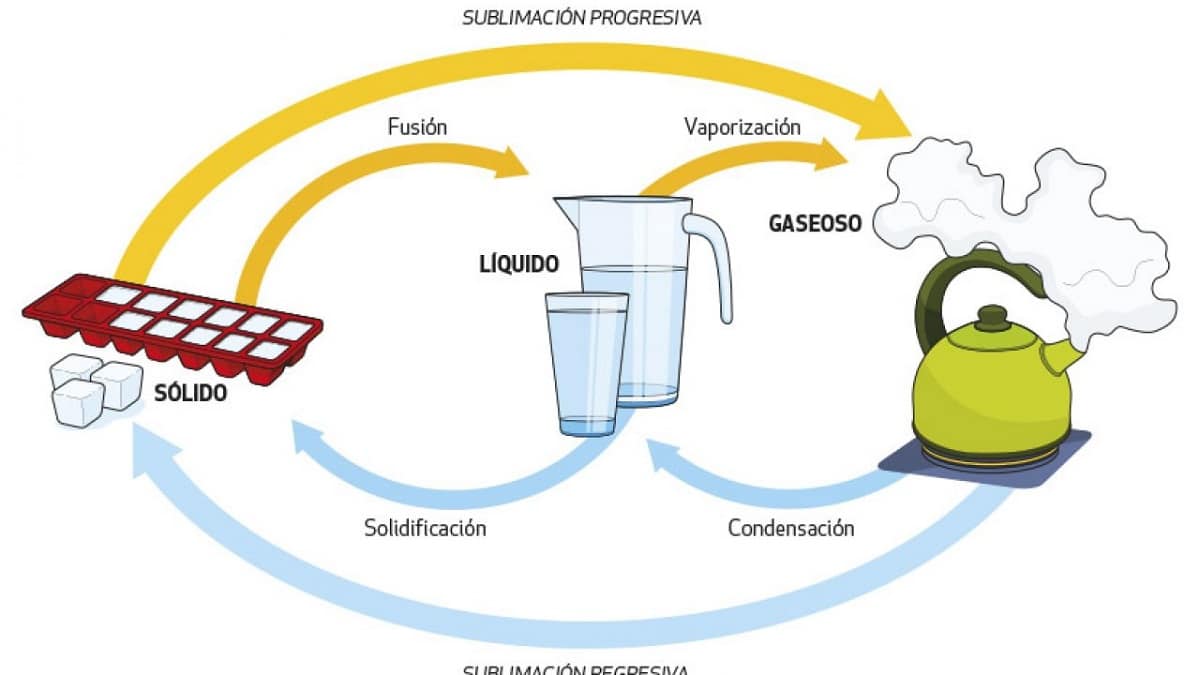
Kao što smo vidjeli u nekim od prethodnih slučajeva, voda može prijeći iz jednog stanja u drugo jednostavno promjenom temperaturnih uvjeta. To se može učiniti u jednom ili drugom smjeru, a svakom ćemo procesu dati svoje ime:
- Isparavanje. Prijelaz iz tekućine u plin povisuje temperaturu vode do 100°C. To je ono što se događa s kipućom vodom, zbog čega je karakteristična po mjehurićima.
- Kondenzacija. Transformacija iz plinovitog u tekuće stanje gubitkom topline. To se događa kada se vodena para kondenzira na kupaonskom zrcalu: površina zrcala je hladnija i para nataložena na njoj postaje tekuća.
- Smrzavanje. Prijelaz iz tekućeg u kruto stanje snižava temperaturu vode ispod 0°C. Voda se smrzava stvarajući led, kao što se događa u našim hladnjacima ili na planinskim vrhovima.
- Topljenje: pretvara čvrstu vodu u tekućinu, toplinu u led. Ovaj proces je uobičajen i može se vidjeti kada dodamo led u piće.
- Sublimacija. Proces prelaska iz plinovitog stanja u čvrsto stanje, u ovom slučaju iz vodene pare izravno u led ili snijeg. Da bi se to dogodilo, potrebni su vrlo specifični uvjeti temperature i tlaka, zbog čega se ova pojava događa na vrhovima planina, primjerice u suši na Antarktici, gdje nema tekuće vode.
- Obrnuta sublimacija: Izravna pretvorba krutine u plin, odnosno iz leda u paru. Možemo ga vidjeti u vrlo suhim okruženjima, kao što je sama polarna tundra ili vrhovi planina, gdje kako se sunčevo zračenje povećava, većina leda sublimira izravno u plin bez prolaska kroz tekuću fazu.
Nadam se da ćete s ovim informacijama moći saznati više o stanjima vode i njezinim karakteristikama.