
La ले डे बॉयल इसकी खोज रॉबर्ट बॉयल ने XNUMXवीं शताब्दी में की थी और गैसों में मौजूद दबाव और आयतन के बीच संबंध को समझाने के लिए नींव रखी थी। प्रयोगों की एक श्रृंखला के माध्यम से, वह यह दिखाने में कामयाब रहे कि यदि तापमान स्थिर है, तो गैस अधिक दबाव के अधीन होने पर अपना आयतन कम कर देती है, और दबाव कम होने पर आयतन में वृद्धि होती है।
इस लेख में हम आपको वह सब कुछ बताने जा रहे हैं जो आपको बॉयल के नियम, इसकी विशेषताओं और महत्व के बारे में जानने के लिए आवश्यक है।
प्रमुख विशेषताएं
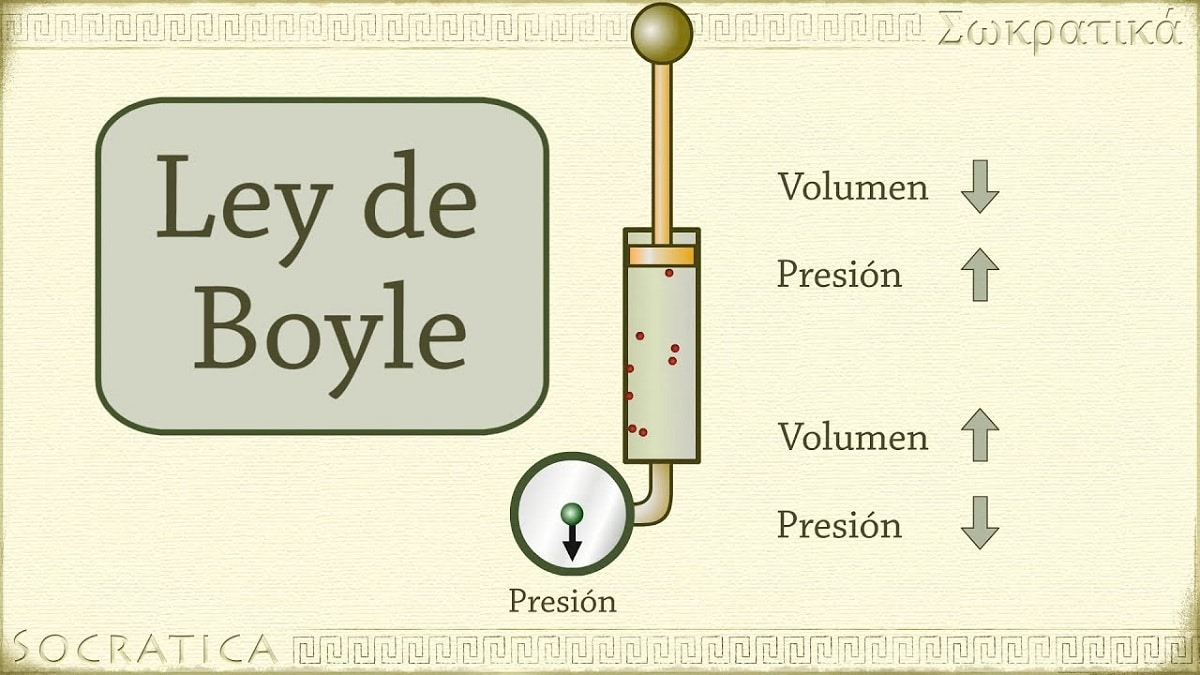
1662 में, रॉबर्ट बॉयल ने पाया कि गैस पर लगाया गया दबाव उसके आयतन और स्थिर तापमान पर मोल की संख्या के व्युत्क्रमानुपाती होता है। दूसरे शब्दों में, यदि किसी गैस पर लगाया गया दाब दोगुना कर दिया जाए, वही गैस संपीडित होगी और उसका आयतन आधा हो जाएगा।
जैसे-जैसे गैस वाले कंटेनर का आयतन बढ़ता है, कंटेनर की दीवारों से टकराने से पहले कणों को जितनी दूरी तय करनी चाहिए, वह भी बढ़ जाती है। दूरी में यह वृद्धि झटके की आवृत्ति को कम करने की अनुमति देती है, इसलिए दीवार पर दबाव पहले की तुलना में कम होता है जब वॉल्यूम छोटा था।
बॉयल के नियम की खोज सबसे पहले 1662 में रॉबर्ट बॉयल ने की थी। एडमे मैरियट एक अन्य वैज्ञानिक थे जिन्होंने बॉयल के समान ही सोचा और उसी निष्कर्ष पर पहुंचेहालांकि, मैरियट ने 1676 तक अपने काम को सार्वजनिक नहीं किया। यही कारण है कि कई किताबों में हमें यह कानून बॉयल और मैरियट के कानून बॉयल-मैरियट के कानून के नाम से जाना जाता है, जिसे मैटट के कानून के रूप में भी जाना जाता है, जिसे ब्रिटिश भौतिक विज्ञानी और रसायनज्ञ रॉबर्ट द्वारा विकसित किया गया था। बॉयल और फ्रांसीसी भौतिक विज्ञानी और वनस्पतिशास्त्री एडमे मैटआउट द्वारा स्वतंत्र रूप से।
यह उन कानूनों में से एक को संदर्भित करता है जो गैस की मात्रा और दबाव को स्थिर तापमान पर बनाए रखा गैस की एक निश्चित मात्रा से संबंधित करता है। बॉयल का नियम निम्नलिखित कहता है: किसी बल द्वारा लगाया गया दबाव भौतिक रूप से गैसीय पदार्थ के आयतन के व्युत्क्रमानुपाती होता है जब तक कि उसका तापमान स्थिर रहता है। या अधिक सरलता से, हम इसकी व्याख्या इस प्रकार कर सकते हैं: उच्च स्थिर तापमान पर, गैस के एक निश्चित द्रव्यमान का आयतन उसके द्वारा लगाए गए स्थिर दबाव के व्युत्क्रमानुपाती होता है।
बॉयल के नियम के प्रयोग और अनुप्रयोग

बॉयल के नियम के सिद्धांत को साबित करने के लिए, मैरियट एक पिस्टन के साथ एक सिलेंडर में गैस को पेश करने का प्रभारी था और पिस्टन के उतरते समय बनाए गए विभिन्न दबावों को सत्यापित करने में सक्षम था। इस प्रयोग से यह निष्कर्ष निकलता है कि जैसे-जैसे आयतन बढ़ता है, दाब घटता जाता है।
आधुनिक जीवन में बॉयल के नियम के कई अनुप्रयोग हैं, जिनमें से हम उदाहरण के लिए डाइविंग का उल्लेख कर सकते हैं, ऐसा इसलिए है क्योंकि गोताखोर को चढ़ते समय अपने फेफड़ों से हवा को बाहर निकालना पड़ता है क्योंकि दबाव कम होने पर यह फैलता है, ऐसा नहीं करने पर ऊतक क्षति हो सकती है।
यह उन सभी उपकरणों में पाया जाता है जो वायवीय शक्ति का उपयोग करते हैं या संचालित होते हैं, जैसे रोबोटिक हथियार जो वायवीय पिस्टन, एक्चुएटर, दबाव नियामक और दबाव राहत वाल्व जैसे घटकों का उपयोग करते हैं।
गैसोलीन, गैस या डीजल इंजन भी आंतरिक दहन के दौरान बॉयल के नियम का उपयोग करते हैं, क्योंकि पहली बार हवा सिलेंडर में आयतन और दबाव के साथ प्रवेश करती है, दूसरी बार यह दबाव बढ़ाकर आयतन कम करती है।
कारों में एयरबैग सिस्टम होते हैं जो बाहरी एयरबैग तक पहुंचने वाले कक्ष से एक निश्चित मात्रा में हवा या गैस को बाहर निकालकर काम करते हैं, जहाँ दाब घटता है और आयतन बढ़ता है जिससे एक स्थिर तापमान बना रहता है।
बॉयल का नियम आज बहुत महत्वपूर्ण है क्योंकि यह वह नियम है जो हमसे बात करता है और गैसों के व्यवहार की व्याख्या करता है। यह निश्चित रूप से बताता है कि गैस का दबाव और आयतन एक दूसरे के व्युत्क्रमानुपाती होते हैं। इसलिए, जब किसी गैस पर दबाव डाला जाता है, तो उसका आयतन कम हो जाता है और उसका दबाव बढ़ जाता है।
आदर्श गैस मॉडल

बॉयल-मैरियोट कानून तथाकथित आदर्श गैसों पर लागू होता है, एक सैद्धांतिक मॉडल जो किसी भी गैस के व्यवहार को बहुत सरल करता है, यह मानते हुए:
- गैस के अणु वे इतने छोटे हैं कि उनके आकार के बारे में सोचना जरूरी नहीं है, विशेष रूप से यह देखते हुए कि यह उनके द्वारा तय की गई दूरी से बहुत कम है।
- इसके अलावा, अणु मुश्किल से बातचीत करते हैं, सिवाय इसके कि जब वे बहुत संक्षिप्त रूप से टकराते हैं, और जब वे टकराते हैं, तो टकराव लोचदार होता है, इसलिए गति और गतिज ऊर्जा दोनों संरक्षित रहती हैं।
- अंत में, मान लीजिए कि यह गतिज ऊर्जा गैसीय नमूने के तापमान के समानुपाती है, अर्थात, कण जितने अधिक उत्तेजित होते हैं, तापमान उतना ही अधिक होता है।
प्रकाश गैसें, उनकी पहचान की परवाह किए बिना, तापमान और दबाव की मानक स्थितियों (यानी: 0ºC और वायुमंडलीय दबाव (1 वातावरण) के तहत इन दिशानिर्देशों का बहुत सख्ती से पालन करती हैं। इन गैसों के लिए, बॉयल-मैरियोट कानून उनके व्यवहार का बहुत सटीक वर्णन करता है। ।
चूँकि P∙V किसी दिए गए तापमान पर स्थिर है, यदि गैस का दबाव बदलता है, तो आयतन में परिवर्तन होता है जिससे उत्पाद समान रहता है, इसलिए दो अलग-अलग अवस्थाओं 1 और 2 में, समानता को निम्नानुसार व्यक्त किया जा सकता है:
पी1∙वी1 = पी2∙वी2
फिर एक राज्य और दूसरे राज्य से एक चर जानने के बाद, आप लापता चर को बॉयल-मैरियट कानून से हटाकर जान सकते हैं।
बॉयल के नियम का इतिहास
ब्रिटिश रसायनज्ञ। रसायन विज्ञान के क्षेत्र में प्रयोगों के अग्रणी, विशेष रूप से गैसों के गुणों में,
कण स्तर पर पदार्थ के व्यवहार पर रॉबर्ट बॉयल की थीसिस रासायनिक तत्वों के आधुनिक सिद्धांत का अग्रदूत था। वह लंदन की रॉयल सोसाइटी के संस्थापक सदस्य भी थे।
रॉबर्ट बॉयल का जन्म आयरलैंड के एक कुलीन परिवार में हुआ था और उन्होंने सर्वश्रेष्ठ अंग्रेजी और यूरोपीय स्कूलों में पढ़ाई की थी। 1656 से 1668 तक उन्होंने ऑक्सफोर्ड विश्वविद्यालय में रॉबर्ट हुक के सहायक के रूप में काम किया, उनके साथ प्रयोगों की एक श्रृंखला में सहयोग किया, जो हवा के भौतिक गुणों को निर्धारित करते थे और यह कैसे जलता है, सांस लेता है और ध्वनि प्रसारित करता है।
इन योगदानों के परिणाम उनके . में एकत्र किए गए थे «हवा की लोच और उसके प्रभावों पर नए भौतिक-यांत्रिक प्रयोग» (1660)। इस काम के दूसरे संस्करण (1662) में, उन्होंने गैसों की प्रसिद्ध संपत्ति, बॉयल-मैरियोट कानून का खुलासा किया, जिसमें कहा गया था कि स्थिर तापमान पर गैस का आयतन उसके दबाव के व्युत्क्रमानुपाती होता है। आज यह ज्ञात है कि यह नियम तभी पूरा होता है जब गैसों के सैद्धांतिक आदर्श व्यवहार को स्वीकार किया जाता है।
मुझे आशा है कि इस जानकारी से आप बॉयल के नियम, विज्ञान की दुनिया में इसकी विशेषताओं और अनुप्रयोगों के बारे में अधिक जान सकते हैं।