
Après la connaissance Le modèle atomique de Thomson, qui considérait les électrons comme étant dans un milieu chargé positivement, un modèle plus avancé connu sous le nom de Modèle atomique de Rutherford. Le scientifique responsable de cette nouvelle avancée pour la science était Ernest Rutherford. Il est né le 20 août 1871 et est décédé le 19 octobre 1937. Au cours de sa vie, il a grandement contribué à la chimie et au monde de la science en général.
Par conséquent, nous allons dédier cet article pour vous dire tout ce que vous devez savoir sur le modèle atomique de Rutherford.
Expérience de la feuille d'or
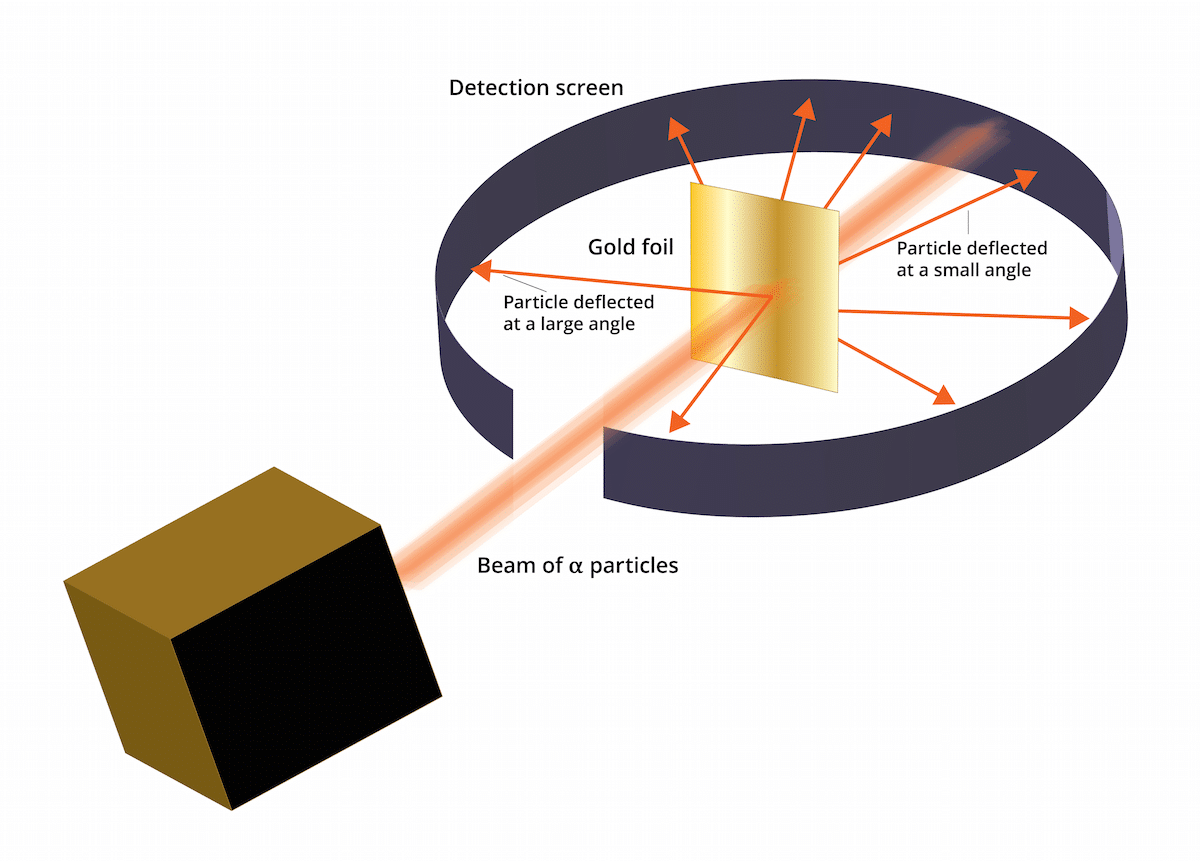
L'ancien modèle Thomson disait que les électrons étaient dans un milieu chargé positivement. En 1909, Ernest Rutherford, accompagné de deux assistants nommés Geiger et Marsden, a fait une étude connue sous le nom d'expérience Gold Leaf où ils ont pu vérifier que Le "pudding aux raisins secs" bien connu de Thomson était faux. Et c'est que cette nouvelle expérience a pu démontrer que l'atome avait une structure à forte charge positive. Cette expérience n'a pas pu aider à rétablir certaines conclusions qui ont fini par être présentées comme le modèle atomique de Rutherford en 1911.
L'expérience connue sous le nom de Feuille d'or n'était pas unique, mais ils ont été réalisés entre 1909 et 1913. Pour cela, ils ont utilisé les laboratoires de physique de l'Université de Manchester. Ces expériences étaient d'une grande importance car de nouvelles conclusions pouvaient être établies à partir de leurs résultats, ce qui a conduit à un modèle atomique révolutionnaire.
Cette expérience consistait en ce qui suit: une fine feuille d'or de seulement 100 nm d'épaisseur a dû être bombardée avec une grande quantité de particules alpha. Ces particules alpha étaient et des ions. Autrement dit, des atomes qui n'ont pas d'électrons, donc ils n'avaient que des protons et des neutrons. En ayant des neutrons et des protons, la charge totale de l'atome était positive. Cette expérience avait principalement pour objectif de corroborer si le modèle de Thomson était correct. Si ce modèle avait raison, les particules alpha devaient traverser les atomes d'or en ligne droite.
Afin d'étudier la déviation provoquée par les particules alpha, un filtre fluorescent au sulfure de zinc a dû être placé autour de la fine feuille d'or. Le résultat de cette expérience est qu'il a été observé que certaines particules étaient capables de traverser les atomes d'or de la feuille en ligne droite. Cependant, certaines de ces particules alpha ont été déviées dans des directions aléatoires.
Conclusions de l'expérience Gold Leaf

Compte tenu de ce fait, il n'a pas été possible de corroborer ce que les modèles atomiques précédents sont considérés. Et c'est que ces modèles atomiques ont souligné que la charge positive était répartie uniformément dans les atomes et cela faciliterait sa traversée puisque sa charge ne serait pas si forte à un certain point.
Les résultats de cette expérience Gold Leaf étaient totalement inattendus. Cela a fait penser à Rutherford que l'atome avait un centre avec une forte charge positive qui faisait qu'une particule alpha essayer de le faire passer rejeté par la structure centrale. Afin d'établir une source plus fiable, les particules ont été considérées en quantités de celles qui étaient réfléchies et de celles qui ne l'étaient pas. Grâce à cette sélection de particules, il a été possible de déterminer la taille du noyau par rapport à l'orbite des électrons qui l'entourent. On pourrait également conclure que la plus grande partie de l'espace d'un atome est vide.
On pouvait voir que certaines particules alpha étaient déviées par la feuille d'or. Certains d'entre eux n'ont dévié que sous de très petits angles. Cela a permis de conclure que la charge positive sur un atome n'est pas uniformément répartie. Autrement dit, la charge positive est située sur un atome de manière concentrée dans un très petit volume d'espace.
Très peu de particules alpha ont dérivé en arrière. Cet écart indique comme suit que lesdites particules pourraient avoir rebondi. Grâce à toutes ces nouvelles considérations, le modèle atomique de Rutherford a pu être établi avec de nouvelles idées.
Le modèle atomique de Rutherford

Nous allons étudier quels sont les principes du modèle atomique de Rutherford:
- Particules qui ont une charge positive à l'intérieur d'un atome ils sont disposés dans un très petit volume si on le compare au volume total dudit atome.
- Presque toute la masse d'un atome se trouve dans ce petit volume mentionné. Cette masse intérieure s'appelait le noyau.
- Électrons qui ont des charges négatives on les trouve en rotation autour du noyau.
- Les électrons tournent à grande vitesse lorsqu'ils sont autour du noyau et ils le font selon des trajectoires circulaires. Ces trajectoires étaient appelées orbites. Plus tard je le ferai ils sont connus comme des orbitales.
- Les électrons chargés négativement et le noyau de l'atome chargé positivement lui-même sont toujours maintenus ensemble grâce à la force d'attraction électrostatique.
Acceptation et limites du modèle atomique de Rutherford
Comme prévu, ce nouveau modèle envisageait un tout nouveau panorama de l'atome dans le monde scientifique. Grâce à ce modèle atomique, de nombreux scientifiques plus tardifs ont pu étudier et déterminer le nombre d'électrons de chaque élément du tableau périodique. De plus, de nouvelles découvertes pourraient être faites pour expliquer le fonctionnement d'un atome de la manière la plus simple.
Cependant, ce modèle présente également certaines limitations et bogues. Même s'il s'agissait d'une percée dans le monde de la physique, ils n'étaient ni un modèle parfait ni un modèle complet. Et est-ce que selon les lois de Newton et un aspect important des lois de Maxwell, ce modèle ne pouvait pas expliquer certaines choses:
- Il ne pouvait pas expliquer comment des charges négatives pouvaient se maintenir ensemble dans le noyau. Selon le tibia électronique, les charges positives doivent se repousser.
- Une autre contradiction concernait les lois fondamentales de l'électrodynamique. Si l'on considère que les électrons à charge positive tournent autour du noyau, ils devraient émettre un rayonnement électromagnétique. En émettant ce rayonnement, l'énergie est consommée pour que les électrons s'effondrent dans le noyau. Par conséquent, le modèle atomique strié ne peut pas expliquer la stabilité de l'atome.
J'espère qu'avec ces informations, vous pourrez en savoir plus sur le modèle atomique de Rutherford.