Fysiikan maailmassa on haara, joka on vastuussa lämmön tuottamien muutosten ja järjestelmässä työskentelyn tutkimisesta. Kyse on termodynamiikka. Fysiikan ala on vastuussa kaikkien sellaisten muutosten tutkimisesta, jotka johtuvat vain prosesseista, joihin liittyy sekä lämpötilan että energian tilamuuttujien muutoksia makroskooppisella tasolla.
Tässä artikkelissa kerromme sinulle kaiken mitä sinun tarvitsee tietää termodynamiikasta ja termodynamiikan periaatteista.
Tärkeimmät ominaisuudet
Jos teemme analyysin klassisesta termodynamiikasta, näemme, että se perustuu makroskooppisen järjestelmän käsitteeseen. Tämä järjestelmä ei ole muuta kuin osa fyysistä tai käsitteellistä massaa, joka on erotettu ulkoisesta ympäristöstä. Termodynaamisten järjestelmien tutkimiseksi oletetaan aina, että se on fyysinen massa, jota energianvaihto ulkoisen ekosysteemin kanssa ei häiritse.
Makroskooppisen järjestelmän tila mikä on tasapainotiloissa se määritetään termodynaamisilla muuttujilla. Tunnemme kaikki nämä muuttujat ja ne ovat lämpötila, paine, tilavuus ja kemiallinen koostumus. Kaikki nämä muuttujat määrittelevät järjestelmät ja niiden tasapainon. Tärkeimmät kemiallisen termodynamiikan merkinnät on vahvistettu sovelletun kansainvälisen liiton ansiosta. Näillä yksiköillä on mahdollista työskennellä paremmin ja selittää termodynamiikan laki.
On kuitenkin termodynamiikan haara, joka ei tutki tasapainoa, mutta on vastuussa termodynaamisten prosessien analysoinnista, joille on pääasiassa tunnusomaista joilla ei ole kykyä saavuttaa tasapainotiloja vakaalla tavalla.
lait
Periaatteet irtisanottiin XNUMX-luvulla He vastaavat kaikkien muutosten ja niiden etenemisen säätelystä. He myös analysoivat todelliset rajat, jotta heillä olisi oikea käsitys. Ne ovat aksiomia, joita ei voida todistaa, mutta joita ei voida todistaa kokemuksen perusteella. Jokainen termodynamiikan teoria perustuu näihin periaatteisiin. Voimme erottaa kolme perusperiaatetta plus periaatteen, mutta se määrittelee lämpötilan ja on implisiittinen muissa kolmessa periaatteessa.
Nolla laki
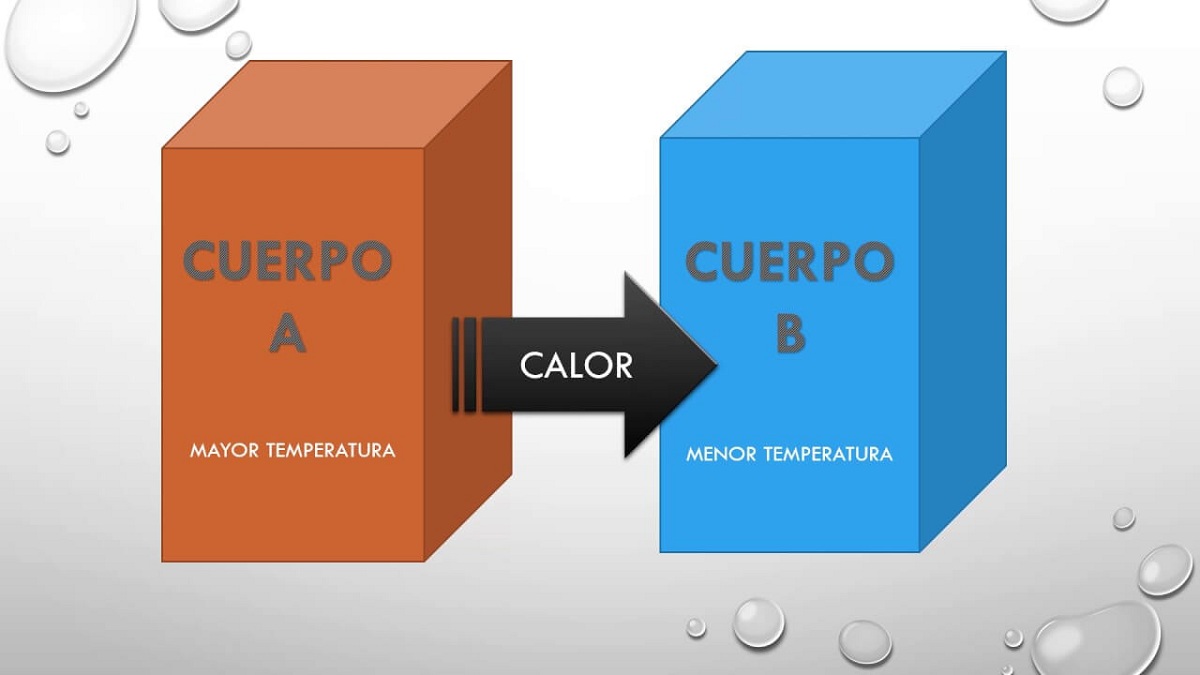
Aiomme kuvata, mikä tämä nollalaki on, joka on ensimmäinen, joka kuvaa lämpötilaa, joka on implisiittinen muissa periaatteissa. Kun kaksi järjestelmää ovat vuorovaikutuksessa toistensa kanssa ja ovat termisessä tasapainossa, niillä on joitakin ominaisuuksia. Nämä keskenään jakamat ominaisuudet voidaan mitata ja antaa numeerinen arvo. Tämän seurauksena, jos nämä kaksi järjestelmää ovat tasapainossa kolmannen kanssa, ne ovat tasapainossa keskenään ja jaettu ominaisuus on lämpötila.
Siksi tämä periaate vain toteaa, että jos runko A oli tasapainossa rungon B kanssa ja tämä runko B on termisessä tasapainossa rungon C kanssa, sitten rungot A ja C ovat myös tasapainossa lämpö. Tämä periaate selittää tosiasian, että kaksi ruumista eri lämpötiloissa voivat vaihtaa lämpöä keskenään. Ennemmin tai myöhemmin molemmat kappaleet saavuttavat saman lämpötilan, joten ne ovat täydellisessä tasapainossa.
Ensimmäinen termodynamiikan laki
Kun ruumis saatetaan kosketukseen kylmemmän ruumiin kanssa, tapahtuu muutos, joka johtaa tasapainotilaan. Tämä tasapainotila perustuu siihen tosiasiaan, että kahden ruumiin lämpötila on sama, koska energiansiirto lisääntyy kylmän ruumiin kuuman rungon välillä. Tämän ilmiön selittämiseksi tutkijat olettivat, että kuuma aine, jota on läsnä suurempia määriä, ohitti kylmemmän rungon. Ajateltiin nestettä, joka voisi liikkua massan läpi voidakseen vaihtaa lämpöä.
Tämä periaate on vastuussa lämmön tunnistamisesta energiamuotona. Se ei ole aineellinen aine. Tällä tavalla voitiin osoittaa, että lämpö, joka mitataan kaloreina, ja työ, joka mitataan jouleina, ovat samanarvoisia. Siksi tiedämme sen tänään Yksi kalori on noin 1 joulea.
Voidaan sanoa, että termodynamiikan ensimmäinen periaate on energian säästämisen periaate. Lämpömoottorin energiamäärä muuttuu työksi ja sen näkee jokainen kone, joka voi tuottaa tällaista työtä kuluttamatta energiaa. Voimme vahvistaa tämän ensimmäisen periaatteen seuraavasti: Suljetun termodynaamisen järjestelmän sisäisen energian vaihtelu on yhtä suuri kuin ero, joka on järjestelmään syötetyn lämmön ja mainitun järjestelmän ympäristössä tekemän työn välillä.
Termodynamiikan toinen laki
Alussa todetaan, että on mahdotonta valmistaa syklistä konetta, joka johtaa vain lämmön siirtymiseen kylmästä kehosta lämpimään. Voimme sanoa, että on mahdotonta suorittaa muutos, jonka tulos on vain että yhdestä lähteestä uutetun lämmön muuntaminen mekaaniseksi työksi.
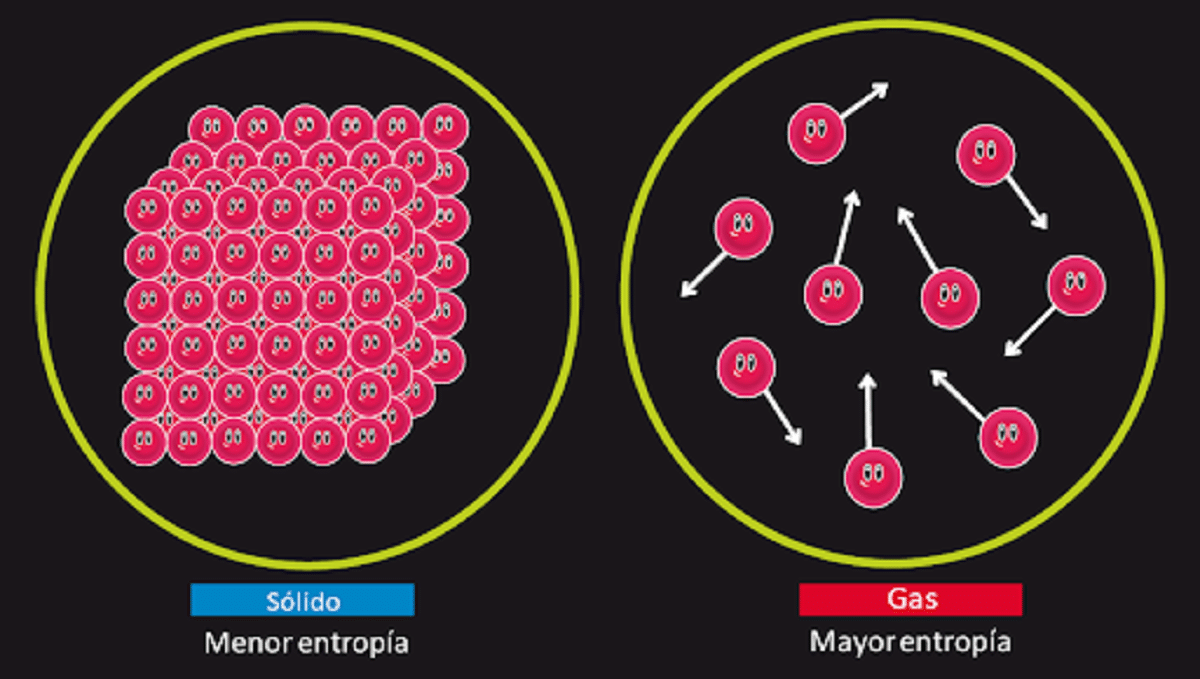
Tämä periaate on vastuussa sen mahdollisuuden kieltämisestä, että toinen laji olisi tunnettu ikuinen liike. Tiedämme, että entropia järjestelmän eristys pysyy muuttumattomana, kun tapahtuu palautuva muutos. Tiedämme myös, että se kasvaa, kun tapahtuu peruuttamaton muutos.
Kolmas termodynamiikan laki
Tämä viimeinen periaate liittyy läheisesti toiseen ja sitä pidetään sen seurauksena. Tämä periaate vahvistaa, että absoluuttista olemusta ei voida saavuttaa värillisenä rajallisella määrällä muunnoksia. Tiedämme, että absoluuttinen nolla ei ole suurempi kuin minimilämpötila, joka voidaan saavuttaa. Yksiköinä Kelvin tiedämme, että se on 0, mutta celsiusasteina sen arvo on -273.15 astetta.
Siinä todetaan myös, että täysin kiteisen kiinteän aineen entropia, jonka lämpötila on 0 kelviiniä, on 0. Tämä tarkoittaa, että entropiaa ei olisi, joten järjestelmä olisi täysin vakaa. Sen muodostavien hiukkasten vapautumis-, siirtymis- ja pyörimisenergia ei olisi mitään 0 kelviinin lämpötilassa.
Toivon, että näiden tietojen avulla voit oppia lisää termodynamiikasta ja perusperiaatteista.