
Kemiallinen muutos on aineen muutos, joka muuttaa sen kemiallista rakennetta, eli se muuttaa sen ominaisuuksia, ei vain sen muotoa. Tämä tarkoittaa, että kemiallinen muutos, joka tunnetaan myös kemiallisena reaktiona tai kemiallisena ilmiönä, sisältää kemiallisten sidosten katkeamisen ja muodostamisen yhdessä aineessa tai yhdisteessä uuden aineen tai yhdisteen muodostamiseksi. Niitä on lukuisia kemiallisia muutoksia maailmassa.
Tästä syystä aiomme omistaa tämän artikkelin kertomaan sinulle tärkeimmistä olemassa olevista kemiallisista muutoksista ja esimerkki niistä.
Mitä ovat kemialliset muutokset?

Kun kaksi tai useampia aineita (kutsutaan lähtöaineiksi tai lähtöaineiksi) joutuvat kemialliseen reaktioon, muuttavat prosessin aikana kemiallista rakennettaan ja voivat kuluttaa (endotermiset reaktiot) tai vapauttavat (eksotermiset reaktiot) energiaa, jolloin syntyy kaksi tai useampia aineita (kutsutaan tuotteeksi). Jotkut kemialliset reaktiot ovat vaarallisia ihmisille, koska ne voivat sisältää tai tuottaa myrkyllisiä tai syövyttäviä yhdisteitä. Muut reaktiot, kuten tietyt eksotermiset reaktiot, voivat aiheuttaa räjähdyksiä.
Kemianteollisuudessa monet jokapäiväisessä elämässämme käyttämämme materiaalit tuotetaan kontrolloiduilla kemiallisilla reaktioilla. Jotkut reaktiot tapahtuvat spontaanisti, toiset joutuvat ihmisten tuottamaan tehtaissa tai kemian laboratorioissa. Kemiallisen reaktion tapahtuminen kestää tietyn ajan. riippuen reagoivien aineiden luonteesta ja olosuhteista, joissa reaktio tapahtuu.
Siksi tekijöitä, jotka vaikuttavat kemiallisten reaktioiden nopeuteen, ovat yleensä:
- Lämpötila nousee. Lämpötilan nousu lisää kemiallisen reaktion nopeutta.
- lisääntynyt paine. Paineen lisääminen yleensä lisää kemiallisen reaktion nopeutta. Tämä tapahtuu yleensä, kun paineen muutoksille herkät aineet, kuten kaasut, reagoivat. Nesteiden ja kiinteiden aineiden tapauksessa paineenmuutokset eivät aiheuta merkittäviä muutoksia niiden reaktionopeudessa.
- Reagenssin aggregaatiotila. Kiinteät aineet reagoivat yleensä hitaammin kuin nesteet tai kaasut, vaikka nopeus riippuu myös kunkin aineen reaktiivisuudesta.
- Katalyytin käyttö. Ne ovat aineita, joita käytetään lisäämään kemiallisten reaktioiden nopeutta. Nämä aineet eivät häiritse reaktiota, ne vain säätelevät reaktion nopeutta. On myös inhibiittoreiksi kutsuttuja aineita, joita käytetään samalla tavalla, mutta joilla on päinvastainen vaikutus, mikä hidastaa reaktiota.
- valoenergia. Jotkut kemialliset reaktiot kiihtyvät, kun valo osuu niihin.
- Reagenssipitoisuus. Useimmat kemialliset reaktiot tapahtuvat nopeammin, jos reagoivien aineiden pitoisuudet ovat korkeat.
Esimerkkejä kemiallisista muutoksista
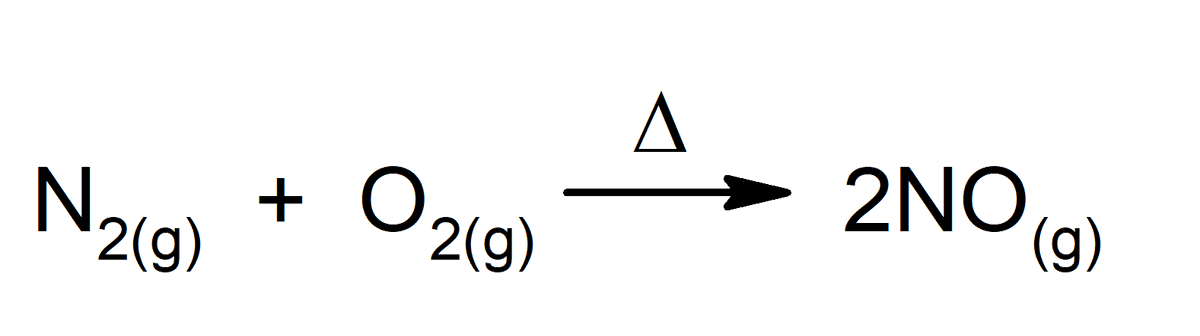
Mikä tahansa kemiallinen reaktio on täydellinen esimerkki kemiallisesta muutoksesta, jopa ne, jotka tapahtuvat kehomme sisällä. Joitakin esimerkkejä ovat:
- Hengitys. Tämä on kemiallisesti muunneltu biologinen prosessi, jossa happea otetaan ilmasta ja käytetään reagoimaan ruoasta saamamme glukoosin kanssa, mikä tuottaa suuria määriä kemiallista energiaa (ATP) ja suuria määriä jätehiilidioksidia (CO2). erittyy.
- Hapan sade. Sitä esiintyy ympäristöissä, joissa on vakava ilmansaaste. Se on yleensä seurausta pilviin varastoidun veden ja muiden ilmaan leviävien kaasujen välisestä kemiallisesta muutoksesta, jonka rikkioksidi- tai typenoksidipitoisuus muodostaa rikkihappoa tai typpihappoa, joka putoaa sadeveden mukana suolaksi. Akun sisällä tapahtuva reaktio on hapon ja metallin välillä. Esimerkiksi lyijyä ja rikkihappoa käyttävä akku tuottaa lyijy(II)sulfaattia, valkoista suolaa. Otsonin hajoaminen. Otsonimolekyylit hajoavat happimolekyyleiksi jonkinlaisen valon vaikutuksesta.
Kemiallinen muutos ja fyysinen muutos

Aineen fysikaaliset muutokset eivät muuta sen koostumusta, eli ne eivät muuta aineen kemiallista rakennetta, joten aineet eivät voi hajota tai muodostua fysikaalisilla muutoksilla. Fyysinen muutos muuttaa yksinkertaisesti aineen fysikaalisia ominaisuuksia, kuten muotoa, tiheyttä ja aggregaatiotilaa (kiinteä, nestemäinen, kaasu). Toisaalta fyysiset muutokset Ne ovat yleensä palautuvia, koska ne muuttavat aineen muotoa tai tilaa, mutta eivät sen koostumusta.
Esimerkiksi veden kiehuessa voimme muuttaa nesteen kaasuksi, mutta tuloksena oleva höyry koostuu silti vesimolekyyleistä. Kääntäen, jos jäädytämme veden, se muuttuu kiinteäksi, mutta on silti kemiallisesti sama aine.
Toinen esimerkki on nesteytetty kaasu, jota käytämme tupakansytyttimissämme, yleensä butaani (C4H10) tai propaani (C3H8), joka muuttuu nesteeksi korkeapaineisessa paineessa, mutta ei muuta kemiallista koostumustaan.
Kemiallinen muutos muuttaa aineen atomien järjestystä ja sitoutumista siten, että ne yhdistyvät eri tavalla, jolloin tuloksena on erilainen aine kuin alkuperäinen. Kun kemiallinen muutos tapahtuu, päädyt aina samaan määrään ainetta, jolla aloitit, vaikka se olisikin eri suhteessa, koska ainetta ei voida luoda tai tuhota, se vain muuttuu.
Esimerkiksi jos saatamme reagoimaan veden (H2O) ja kaliumin (K) kanssa, saadaan kaksi uutta ainetta: kaliumhydroksidia (KOH) ja vetykaasua (H2). Tämä on reaktio, joka vapauttaa yleensä paljon energiaa ja on siksi erittäin vaarallinen.
Esimerkkejä aineen kemiallisista muutoksista
Leivotaan keksejä tai kakkuja
Yleisiä asioita, kuten keksit, kakut, kuppikakut jne. piilottaa kemiallisen reaktion nimeltä fermentaatio, jossa taikina kohoaa hiivan tuottamien kaasujen takia. Leivän valmistuksessa hiiva muuttaa tärkkelyksen glukoosiksi.
ruoansulatus
Ruoan sulattaminen on ilmeinen esimerkki aineen kemiallisesta muutoksesta hydrolyysin kautta (orgaanisen aineen hajoaminen veden vaikutuksesta). Ruoka, jota syömme hedelmien, vihannesten, lihan jne., ne käyvät läpi prosessin, jossa ne sekoittuvat mahanesteen kanssa ravinteiden paremmin imeytymiseksi ja muuntaa ne erilaisiksi aineiksi organismin tarpeiden mukaan.
Samassa prosessissa ylimääräiset alkuaineet tai toksiinit poistetaan organismista eri tavalla kuin alkuperäinen; ulosteen, virtsan, hien jne. muodossa.
pulque
Fermentaatio on katabolinen prosessi, jossa glukoosimolekyylit hajoavat hapen puutteen vuoksi. Jotkut käymisprosessin kautta saatavista alkoholijuomista ovat siideri, olut ja pehmeä viini, joista jälkimmäinen on yksi vähiten tunnetuista juomista maailmassa. Pulque saadaan agavekasvista artesaaniprosessillal, jossa aineen kypsyminen on avainasemassa, jotta saadaan lopputuote, joka on valkoinen, hapan ja viskoosi ja jolla on hyvin erityinen maku, joka ei sovi mihinkään makuun.
Käyminen tapahtuu myös muun muassa leivän, jogurtin ja juuston valmistuksessa.
Caramelo
Karamelli on perusesimerkki kemiallisesta aineen muutoksesta, sillä kiinteä valkoinen sokeri muuttuu muutaman minuutin ajan kuumennetussa meripihkanväriseksi massaksi, jolla on miellyttävä tuoksu. Toisin sanoen syntyy tuote, joka on täysin erilainen kuin alkuperäinen.
Toivon, että näiden tietojen avulla voit oppia lisää kemiallisista muutoksista ja niiden esimerkeistä.