
Olet varmasti koskaan nähnyt Bohrin atomimalli. Tämä on melko tärkeä löytö, jonka tämä tiedemies teki tieteen, erityisesti sähkömagneettisuuden ja sähkökemian suhteen. Aikaisemmin siellä oli Rutherford-malli, joka oli varsin vallankumouksellinen ja erittäin onnistunut, mutta oli joitain ristiriitoja muiden atomilakien, kuten Maxwellin ja Newtonin, kanssa.
Tässä artikkelissa kerromme sinulle kaiken, mitä sinun tarvitsee tietää Bohrin atomimallista, sekä sen yksityiskohdat selvittääkseen epäilyksiä aiheesta.
Ongelmat, jotka se auttoi ratkaisemaan
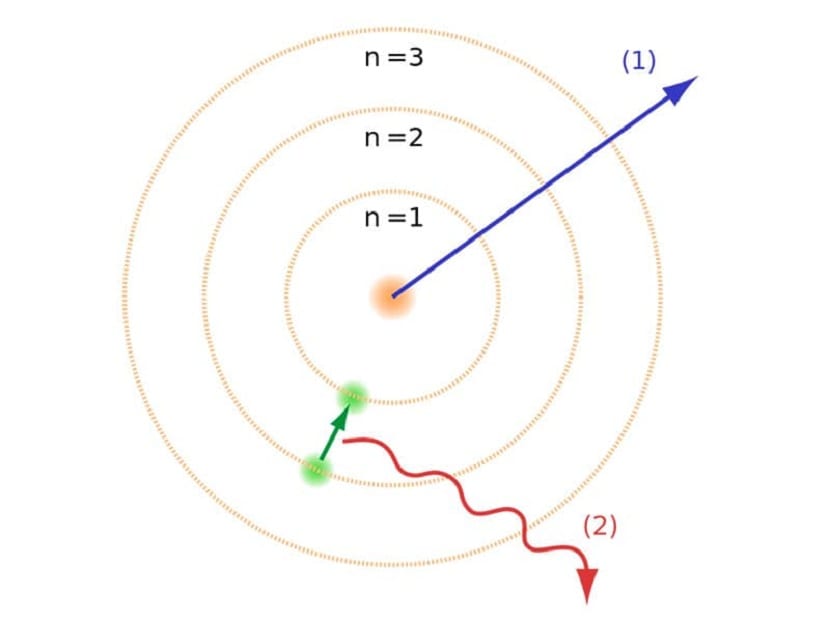
Kuten mainitsimme artikkelin alussa, tämä atomimalli auttoi ratkaisemaan tiettyjä ristiriitoja, jotka olivat olemassa muiden atomilakien kanssa. Edellisessä Rutherford-mallissa meidän piti negatiivisella sähkövarauksella liikkuvien elektronien oli lähetettävä tietyntyyppinen sähkömagneettinen säteily. Tämän pitäisi tapahtua sähkömagneettisuuden lakien takia. Tämä energian menetys aiheuttaa elektronien vähenemisen kiertoradalleen kiertämällä kohti keskustaa. Saavuttuaan keskustaan he romahtivat törmäämällä ytimeen.
Tämä aiheutti teoriassa ongelman, koska se ei voinut romahtaa atomien ytimen kanssa, mutta elektronien liikeradan oli oltava erilainen. Tämä ratkaistiin Bohrin atomimallilla. Se selittää sen elektronit kiertävät ytimen ympäri tietyillä sallituilla kiertoradoilla ja joilla on tietty energia. Energia on verrannollinen Planckin vakioon.
Näitä kiertoratoja, jotka olemme maininneet elektronien liikkuessa, kutsuttiin energiakerroksiksi tai energiatasoiksi. Eli elektronien energia ei ole aina sama, mutta se kvantisoidaan. Kvanttitasot ovat erilaisia kiertoratoja, joissa atomeja esiintyy. Riippuen siitä, missä kiertoradalla se on kulloinkin, sillä on enemmän tai vähemmän energiaa. Kiertoradoilla, jotka ovat lähempänä atomin ydintä, on suurempi energiamäärä. Toisaalta, mitä enemmän he siirtyvät pois ytimestä, sitä vähemmän energiaa.
Energiatason malli
Tämä Bohrin atomimalli, joka tarkoitti, että elektronit voisivat saada tai menettää energiaa vain hyppäämällä kiertoradalta toiselle, auttoi ratkaisemaan Rutherfordin mallin ehdottaman romahduksen. Siirtyessään energiatasolta toiselle se absorboi tai lähettää sähkömagneettista säteilyä. Toisin sanoen, kun siirryt enemmän varatusta energiatasosta vähemmän ladattuun, vapautat ylimääräisen energian. Päinvastoin, kun se siirtyy matalalta energiatasolta korkeammalle, se absorboi sähkömagneettista säteilyä.
Koska tämä atomimalli on muunnos Rutherford-mallista, pienen keskiytimen ominaisuudet ja suurin osa atomin massasta säilyvät. Vaikka elektronien kiertoradat eivät ole tasaiset kuin planeettojen, voidaan sanoa, että nämä elektronit pyörivät ytimensä ympäri samalla tavalla kuin planeetat Auringon ympäri.
Bohrin atomimalliperiaatteet

Aiomme nyt analysoida tämän atomimallin periaatteita. Kyse on yksityiskohtaisesta selityksestä mainitusta mallista ja sen toiminnasta.
- Hiukkaset, joilla on positiivinen varaus Ne ovat pieninä pitoisuuksina verrattuna atomin kokonaistilavuuteen.
- Negatiivisen sähkövarauksen omaavat elektronit ovat niitä, jotka havaitaan pyörivän ytimen ympäri pyöreillä energian kiertoradoilla.
- Kiertoradoilla on energiatasoja, joiden läpi elektronit kiertävät. Heillä on myös asetettu koko, joten kiertoradojen välillä ei ole välitilaa. He vain siirtyvät tasolta toiselle.
- Kullakin kiertoradalla oleva energia liittyy sen kokoon. Mitä kauempana kiertorata on atomin ytimestä, sitä enemmän sillä on energiaa.
- Energiatasoilla on erilainen määrä elektroneja. Mitä alhaisempi energiataso, sitä vähemmän elektroneja se sisältää. Esimerkiksi, jos olemme tasolla 2, siellä on jopa kaksi elektronia. Tasolla 8 voi olla jopa XNUMX elektronia, niin edelleen.
- Kun elektronit siirtyvät kiertoradalta toiselle, ne absorboivat tai vapauttavat sähkömagneettista energiaa. Jos siirryt yhdeltä energeettisemmältä tasolta toiselle vähemmän, vapautat ylimääräisen energian ja päinvastoin.
Tämä malli oli vallankumouksellinen ja yritti antaa vakautta materiaalille, jota edellisillä malleilla ei ollut. Kaasujen erilliset emissio- ja absorptiospektrit selitettiin myös tällä atomimallilla. Se oli ensimmäinen malli, joka esitteli kvantisoinnin tai kvantisoinnin käsitteen. Tämä tekee Bohrin atomimallista mallin, joka on puolivälissä klassisen mekaniikan ja kvanttimekaniikan välillä. Vaikka sillä on myös puutteita, se oli edeltäjämalli Schrödingerin ja muiden tutkijoiden myöhemmälle kvanttimekaniikalle.
Bohrin atomimallin rajoitukset ja virheet
Kuten olemme maininneet, tällä mallilla on myös tiettyjä puutteita ja virheitä. Ensinnäkin, se ei selitä tai esitä syitä, miksi elektroneja on rajoitettava vain tiettyihin kiertoradoihin. Se olettaa suoraan, että elektronilla on tunnettu säde ja kiertorata. Näin ei kuitenkaan ole. Vuosikymmen myöhemmin Heisenbergin epävarmuusperiaate kumosi tämän.
Vaikka tämä atomimalli pystyi mallintamaan elektronien käyttäytymistä vetyatomissa, se ei ollut niin tarkka, kun on kyse elementeistä, joilla oli suurempi määrä elektroneja. Se on malli, joka on vaikeuksia selittää Zeeman-vaikutusta. Tämä vaikutus on se, mitä voidaan nähdä, kun spektriviivat jaetaan kahteen tai useampaan ulkoisen ja staattisen magneettikentän läsnä ollessa.
Toinen tämän mallin virheistä ja rajoituksista on se, että se antaa väärän arvon perustilan kiertoradan kulmamomentille. Kaikki nämä mainitut virheet ja rajoitukset tekevät Bohrin atomimallista vuosia myöhemmin kvanttiteorian.
Toivon, että tällä artikkelilla voit oppia lisää Bohrin atomimallista ja sen sovelluksista tieteessä.