
L'àtom és la unitat bàsica de la matèria i és la fracció més petita que pot identificar un element químic. Consisteix en un nucli atòmic que conté neutrons i protons, i electrons que envolten el nucli. El terme àtom es deriva del grec i significa indivisible. Tot i això, moltes persones no saben bé què és un àtom ni quines en són les característiques.
Per això, dedicarem aquest article a explicar-te què és un àtom, les seves característiques i importància.
Què és un àtom

Els àtoms consten d'una part central anomenada nucli, on resideixen els protons (partícules carregades positivament) i els neutrons (partícules elèctricament neutres). La regió al voltant del nucli està ocupada per electrons (partícules carregades negativament); aquesta regió es diu capa elèctrica. La capa elèctrica (carregada negativament) i el nucli (carregat positivament) es mantenen units per atracció elèctrica.
El diàmetre mitjà d‟un àtom és d‟uns 10-10 metres, i el diàmetre mitjà d‟un nucli és d‟uns 10-15 metres; per tant, un àtom té un diàmetre de 10.000 a 100.000 vegades més gran que el seu nucli. Per exemple, si un àtom té la mida d\'un camp de futbol, el nucli tindrà la mateixa mida que la pilota al centre del camp. Si un àtom té 100 metres de diàmetre, el nucli té 1 centímetre de diàmetre.
Una mica d'història

El filòsof grec Aristòtil (384 aC – 322 aC) va intentar explicar la composició de tota la matèria a partir dels elements: terra, aire, foc i aigua. Demòcrit (546 aC – 460 aC) va ser un científic i matemàtic grec que va proposar la idea que hi havia un límit per a la mida de les partícules. Aquestes partícules es tornen tan petites que ja no es poden dividir, va dir. Va trucar a aquestes partícules «àtoms».
Durant la major part del segle XIX, va ser el model atòmic del científic britànic Dalton qui va proposar la teoria atòmica, que estava molt més enllà del pensament dels antics en aquell moment.
Aquesta teoria diu que tota la matèria està formada per petites partícules indivisibles anomenades àtoms. Investigacions recents han trobat que els àtoms estan formats per altres partícules petites anomenades partícules subatòmiques.
Històricament, s'han desenvolupat diferents teories atòmiques sobre la composició de la matèria abans que s'obtingués el coneixement actual sobre l'estructura atòmica. Amb base a la teoria atòmica, els científics han demostrat models d'àtoms que evolucionen gradualment.
El primer model proposat per John Dalton es va desenvolupar fins a arribar al model de l'àtom de Niels Bohr. Bohr va proposar un model molt semblant al model actual d'electrons que orbiten al voltant del nucli.
Estructura d'un àtom
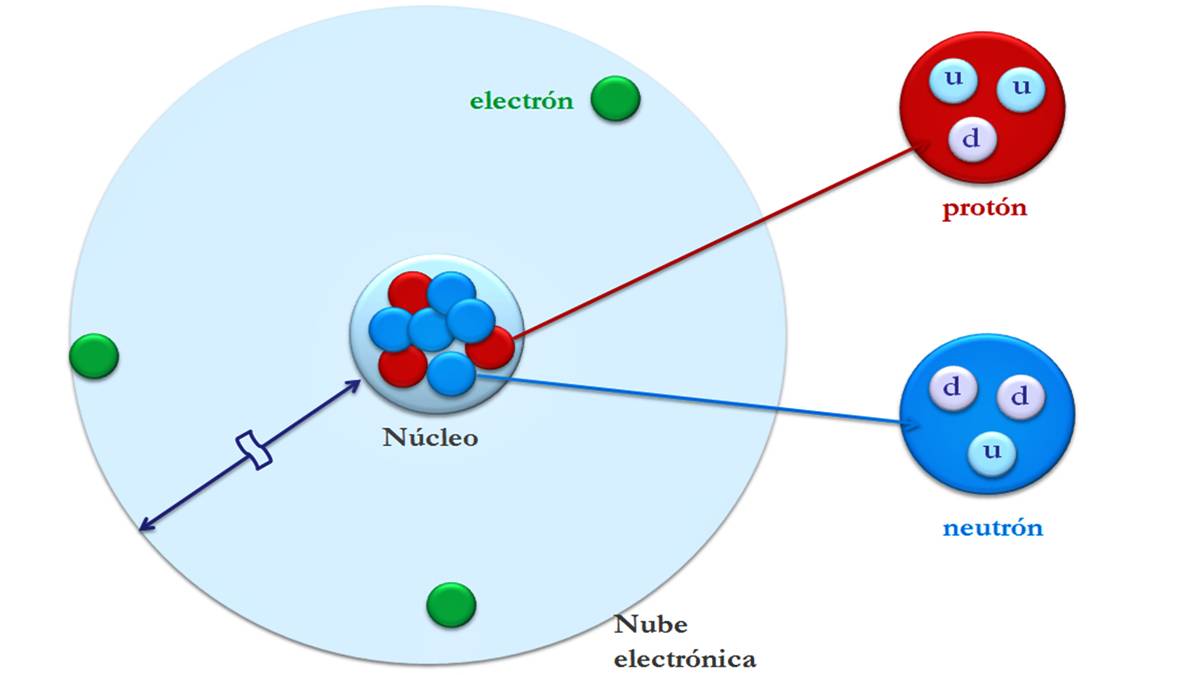
Els àtoms estan formats per partícules diminutes anomenades partícules subatòmiques: electrons, protons i neutrons. La major part de la massa d'un àtom es concentra al nucli. I el seu volum més gran és a la capa elèctrica on es troben els electrons.
Electrons, protons i neutrons
Els electrons tenen càrrega negativa i gairebé no tenen massa. La seva massa és unes 1840 vegades la del nucli atòmic. Són partícules diminutes que giren al voltant del nucli central d'un àtom. A més, es mouen ràpidament al voltant del nucli generant un camp electromagnètic.
Un protó té la mateixa càrrega positiva que la càrrega d'un electró en valor absolut, i per això els protons i els electrons tendeixen a atraure's entre si. Aquests constitueixen la unitat de massa i, juntament amb els neutrons, formen el nucli de l'àtom.
Els neutrons no tenen càrrega, és a dir, tenen càrrega neutra. Juntament amb els protons, forma el nucli i representa gairebé tota la massa (99,9%) de l'àtom. Els neutrons proporcionen estabilitat al nucli.
Els àtoms tenen nivells d'energia, set capes al voltant del nucli on hi ha electrons que orbiten al voltant del nucli. Les capes s'anomenen K, L, M, N, O, P i Q. Cada capa pot contenir un nombre finit d'electrons: vuit electrons per capa. La capa més externa és sempre la més dinàmica. Només l'àtom d'hidrogen no té neutrons i només un electró orbita al voltant del protó.
Característiques químics
En química, els àtoms són les unitats fonamentals que solen conservar les seves propietats originals a cada reacció. No es destrueixen ni es creen, simplement s'organitzen de maneres diferents amb diferents connexions entre ells.
Els àtoms s'agrupen per crear molècules i altres tipus de materials. Els enllaços creats a les reaccions químiques tenen una determinada composició que distingeix els diferents elements químics. Aquests elements són els que apareixen a la taula periòdica d'elements.
Cadascun d'aquests elements té molts protons al nucli. Aquest número s'anomena número atòmic i es denota amb la lletra Z. Tots els àtoms amb el mateix nombre de protons pertanyen al mateix element i tenen les mateixes propietats químiques encara que siguin elements químics diferents.
D'altra banda, trobem el nombre de massa, denotat per la lletra A. Aquest nombre es refereix al nombre de nucleons presents a l'àtom. Un altre tipus d'àtom que podem trobar, i del que coneixem millor, és un isòtop. Aquests àtoms tenen el mateix nombre de protons, però diferent nombre de neutrons. Tenen les mateixes propietats químiques, encara que les seves propietats físiques són diferents entre si.
Com hem assenyalat abans, els isòtops són molt importants. I són vitals per a l'energia nuclear perquè l'enriquiment d'urani implica convertir un isòtop d'urani en un altre amb una estructura química més inestable, cosa que ens permet tenir una reacció en cadena.
Propietats
Les propietats que defineixen un àtom són:
- Número atòmic (Z) que indica el nombre de protons al nucli. Tots els àtoms amb el mateix nombre de protons pertanyen al mateix element. Per exemple, un àtom d'hidrogen amb un sol protó.
- El nombre de massa es refereix a la suma de protons i neutrons. Els elements amb diferent nombre de neutrons són diferents isòtops del mateix element.
- L'electronegativitat és la tendència dels àtoms a atraure electrons quan formen enllaços químics.
- El radi atòmic correspon a la meitat de la distància entre dos nuclis del mateix element units.
- El potencial d'ionització és lenergia necessària per separar un electró dun element.
Espero que amb aquesta informació pugueu conèixer més sobre què és un àtom i les seves característiques.
MOLT BO
RICARDO