পদার্থবিজ্ঞানের ক্ষেত্রে, তাপ দ্বারা উত্পাদিত রূপান্তরগুলি অধ্যয়নের দায়িত্বে একটি শাখা রয়েছে এবং সিস্টেমে কাজ করে। এটা তাপগতিবিদ্যা সম্পর্কে। এটি পদার্থবিজ্ঞানের একটি শাখা যা সমস্ত রূপান্তরের অধ্যয়নের জন্য দায়ী, যা শুধুমাত্র একটি প্রক্রিয়ার ফলাফল যা ম্যাক্রো স্তরে তাপমাত্রা এবং শক্তির রাষ্ট্রীয় পরিবর্তনশীলতার সাথে জড়িত। বেশ কয়েকটি আছে তাপগতিবিদ্যার নীতি যা পদার্থবিজ্ঞানের অনেক দিকের মৌলিক।
অতএব, আমরা আপনাকে এই প্রবন্ধে বলতে যাচ্ছি যে তাপগতিবিদ্যার নীতিগুলি কী এবং এর গুরুত্ব কী।
তাপগতিবিদ্যার বৈশিষ্ট্য
যদি আমরা শাস্ত্রীয় তাপগতিবিদ্যা বিশ্লেষণ করি, আমরা দেখতে পাব যে এটি ম্যাক্রোস্কোপিক সিস্টেমের ধারণার উপর ভিত্তি করে। এই সিস্টেমটি বাহ্যিক পরিবেশ থেকে পৃথক হওয়ার শারীরিক বা ধারণাগত মানের একটি অংশ মাত্র। থার্মোডাইনামিক সিস্টেমকে আরও ভালভাবে অধ্যয়ন করার জন্য, এটি সর্বদা অনুমান করা হয় যে এটি একটি শারীরিক ভর এটি বাহ্যিক বাস্তুতন্ত্রের সাথে শক্তির বিনিময় দ্বারা বিরক্ত হয় না।
ভারসাম্যে একটি ম্যাক্রোস্কোপিক সিস্টেমের অবস্থা থার্মোডাইনামিক ভেরিয়েবল নামক পরিমাণ দ্বারা নির্দিষ্ট করা হয়। আমরা এই সব ভেরিয়েবল জানি: তাপমাত্রা, চাপ, আয়তন এবং রাসায়নিক গঠন। এই সমস্ত ভেরিয়েবল সিস্টেম এবং এর ভারসাম্য নির্ধারণ করে। অ্যাপ্লিকেশনগুলির আন্তর্জাতিক জোটকে ধন্যবাদ, রাসায়নিক তাপগতিবিদ্যার প্রধান চিহ্নগুলি প্রতিষ্ঠিত হয়েছে। এই ইউনিটগুলি ব্যবহার করা ভাল কাজ করতে পারে এবং তাপগতিবিদ্যার নীতিগুলি ব্যাখ্যা করতে পারে।
যাইহোক, তাপগতিবিদ্যার একটি শাখা আছে যা ভারসাম্য অধ্যয়ন করে না, বরং, তারা থার্মোডাইনামিক প্রক্রিয়া বিশ্লেষণের জন্য দায়ী যা প্রধানত একটি স্থিতিশীল উপায়ে ভারসাম্যপূর্ণ অবস্থা অর্জনের ক্ষমতা না থাকার দ্বারা চিহ্নিত করা হয়।
তাপগতিবিদ্যার নীতি
থার্মোডাইনামিক্সের 4 টি নীতি রয়েছে, শূন্য থেকে তিন পয়েন্ট পর্যন্ত তালিকাভুক্ত, এই আইনগুলি আমাদের মহাবিশ্বের পদার্থবিজ্ঞানের সমস্ত আইন বুঝতে সাহায্য করে এবং আমাদের বিশ্বে নির্দিষ্ট কিছু ঘটনা দেখা অসম্ভব। এগুলি থার্মোডাইনামিক্সের আইন নামেও পরিচিত। এই আইনের বিভিন্ন উৎপত্তি আছে। কিছু পূর্ববর্তী সূত্র থেকে তৈরি করা হয়। তাপগতিবিদ্যার সর্বশেষ জানা আইন হল শূন্য আইন। এই আইনগুলি ল্যাবরেটরিতে পরিচালিত সমস্ত তদন্ত এবং তদন্তে স্থায়ী। আমাদের মহাবিশ্ব কীভাবে কাজ করে তা বোঝার জন্য এগুলি অপরিহার্য। আমরা একে একে তাপগতিবিদ্যার নীতি বর্ণনা করব।
প্রথম নীতি
এই আইন বলে যে শক্তি তৈরি বা ধ্বংস করা যায় না, এটি কেবল রূপান্তরিত হতে পারে। এটি শক্তি সংরক্ষণের আইন নামেও পরিচিত। আসলে, এর অর্থ হল যে তার পরিবেশ থেকে বিচ্ছিন্ন যেকোনো ভৌত ব্যবস্থায়, তার সমস্ত শক্তি সর্বদা একই থাকবে। যদিও শক্তিকে এক বা অন্য রূপে অন্য ধরনের শক্তিতে রূপান্তরিত করা যায়, এই সব শক্তির সমষ্টি সবসময় একই থাকে।
আমরা এটিকে আরও ভালভাবে বোঝার জন্য একটি উদাহরণ দেব। এই নীতি অনুসরণ করে, যদি আমরা তাপের আকারে একটি ভৌত ব্যবস্থায় একটি নির্দিষ্ট পরিমাণ শক্তির অবদান রাখি, আমরা অভ্যন্তরীণ শক্তির বৃদ্ধি এবং সিস্টেম এবং এর আশেপাশের কাজগুলির মধ্যে পার্থক্য খুঁজে বের করে মোট শক্তি গণনা করতে পারি। অর্থাৎ, সেই মুহূর্তে সিস্টেমের যে শক্তি আছে এবং যে কাজটি করেছে তার মধ্যে পার্থক্য হবে মুক্তি পাওয়া তাপশক্তি।
দ্বিতীয় নীতি
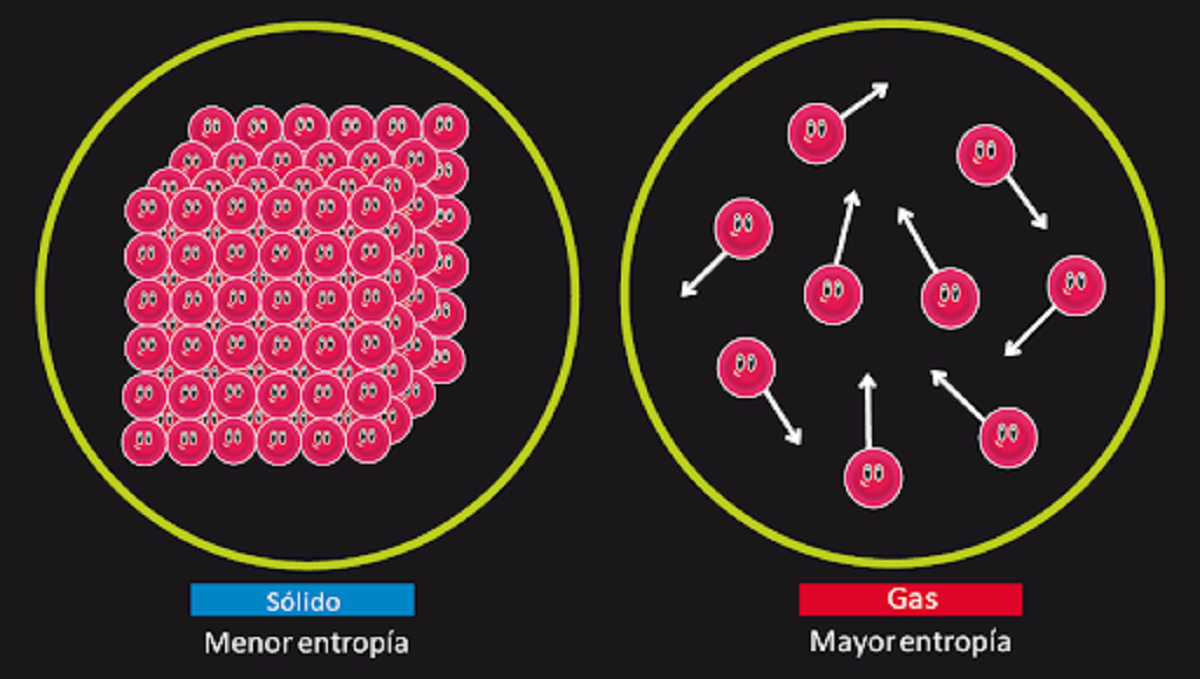
পর্যাপ্ত সময় থাকলে, সমস্ত সিস্টেম অবশেষে তাদের ভারসাম্য হারাবে। এই নীতিটিকে এনট্রপির আইনও বলা হয়। এটি নিম্নরূপ সংক্ষিপ্ত করা যেতে পারে। মহাবিশ্বে এনট্রপির পরিমাণ সময়ের সাথে বৃদ্ধি পাবে। সিস্টেমের এনট্রপি হ'ল বিশৃঙ্খলার মাত্রা পরিমাপের একটি সূচক। অন্য কথায়, তাপগতিবিদ্যার দ্বিতীয় নীতি আমাদের বলে যে একবার সিস্টেমটি ভারসাম্যের একটি বিন্দুতে পৌঁছায়, এটি সিস্টেমে বিশৃঙ্খলার মাত্রা বাড়িয়ে দেবে। এর অর্থ এই হতে পারে যে যদি আমরা একটি সিস্টেমকে পর্যাপ্ত সময় দিই, তাহলে এটি শেষ পর্যন্ত ভারসাম্যহীন হয়ে যাবে।
এই আইনটি কিছু শারীরিক ঘটনার অপরিবর্তনীয়তা ব্যাখ্যা করার জন্য দায়ী। উদাহরণস্বরূপ, এটি আমাদের ব্যাখ্যা করতে সাহায্য করে কেন একটি কাগজ একটি কাগজ পুড়ে গেছে তার মূল আকৃতিতে ফিরে আসতে পারে না। কাগজ ও অগ্নি হিসাবে পরিচিত এই ব্যবস্থায় ব্যাধি এত বেশি বেড়েছে যে এর উত্সে ফিরে আসা সম্ভব নয়। এই আইনটি এন্ট্রপি রাষ্ট্রীয় ক্রিয়াকলাপটি প্রবর্তন করে, যা শারীরিক ব্যবস্থাগুলির ক্ষেত্রে ব্যাধি এবং তার অনিবার্য শক্তি ক্ষতির প্রতিনিধিত্ব করার জন্য দায়ী।
তাপগতিবিদ্যার দ্বিতীয় নীতি বুঝতে আমরা একটি উদাহরণ দিতে যাচ্ছি। যদি আমরা একটি নির্দিষ্ট পরিমাণ পদার্থ পুড়িয়ে ফেলি এবং ফলস্বরূপ ছাই দিয়ে আমরা বলটি একসাথে রাখি, আমরা যাচাই করতে পারি যে প্রাথমিক অবস্থায় কম পদার্থ আছে। কারণ বস্তু গ্যাসে পরিণত হয়েছে এগুলো উদ্ধার করা যাবে না এবং তাদের ছড়িয়ে -ছিটিয়ে থাকতে হবে। এইভাবে আমরা দেখতে পাই যে এক রাজ্যে অন্তত দুইটি রাজ্যের তুলনায় এনট্রপি ছিল।
তৃতীয় নীতি
যখন পরম শূন্য পৌঁছে যায়, ভৌত সিস্টেম প্রক্রিয়া বন্ধ হয়ে যায়। পরম শূন্য হল সর্বনিম্ন তাপমাত্রা যা আমরা পৌঁছাতে পারি। এই ক্ষেত্রে, আমরা ডিগ্রী কেলভিনে তাপমাত্রা পরিমাপ করি। এইভাবে, এটা বলা যেতে পারে যে তাপমাত্রা এবং কুলিং সিস্টেমের এনট্রপি শূন্য হতে পারে। এই ক্ষেত্রে, এটি একটি নির্দিষ্ট ধ্রুবকের মতো। যখন এটি পরম শূন্যে পৌঁছায়, তখন ভৌত সিস্টেম প্রক্রিয়া বন্ধ হয়ে যায়। অতএব, এনট্রপির একটি ন্যূনতম কিন্তু ধ্রুবক মান থাকবে।
পরম শূন্য বা না পৌঁছানো একটি সহজ কাজ। কেলভিন ডিগ্রির পরম শূন্য মান শূন্য, কিন্তু যদি আমরা এটি ব্যবহার করি সেলসিয়াস তাপমাত্রা স্কেল পরিমাপ, -273,15 ডিগ্রী।
শূন্য আইন
এই আইন হল পরেরটি অনুমান করে এবং বলে যে যদি A = C এবং B = C হয়, তাহলে A = B। এটি থার্মোডায়নামিক্সের অন্যান্য তিনটি আইনের মূল এবং মৌলিক নিয়মগুলি প্রতিষ্ঠিত করে। এটি এমন একটি নাম যা তাপীয় ভারসাম্যের আইন ধরে নেয়। অন্য কথায়, যদি সিস্টেম এবং অন্যান্য সিস্টেমগুলি স্বাধীনভাবে তাপীয় ভারসাম্যে থাকে তবে সেগুলি অবশ্যই তাপীয় ভারসাম্যে থাকতে হবে। এই আইন তাপমাত্রার নীতিগুলি প্রতিষ্ঠার অনুমতি দেয়। তাপীয় ভারসাম্যহীন অবস্থায় দুটি ভিন্ন বস্তুর তাপ শক্তির তুলনা করতে এই নীতি ব্যবহার করা হয়। যদি এই দুটি বস্তু তাপীয় ভারসাম্যে থাকে তবে সেগুলি একই তাপমাত্রায় অপ্রয়োজনীয় হবে। অন্যদিকে, যদি তারা উভয়ই তৃতীয় সিস্টেমের তাপীয় ভারসাম্য পরিবর্তন করে, তবে তারা একে অপরকে প্রভাবিত করবে।
আমি আশা করি যে এই তথ্যের সাহায্যে আপনি এর বৈশিষ্ট্যগুলির তাপগতিবিদ্যার নীতি সম্পর্কে আরও জানতে পারবেন।