
Със сигурност някога сте виждали Атомният модел на Бор. Това е доста важно откритие, което този учен направи за науката, особено за електромагнетизма и електрохимията. Преди имаше моделът на Ръдърфорд, който беше доста революционен и много успешен, но имаше някои конфликти с други атомни закони като този на Максуел и Нютон.
В тази статия ще ви разкажем всичко, което трябва да знаете за атомния модел на Бор, както и неговите подробности, за да изясните всякакви съмнения по въпроса.
Проблеми, които помогна да се решат
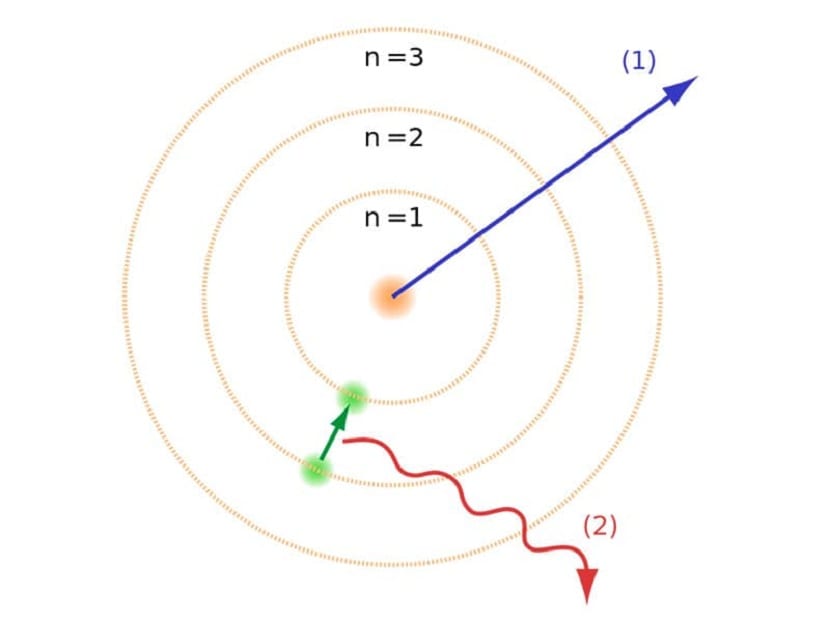
Както споменахме в началото на статията, този атомен модел спомогна за разрешаването на определени конфликти, съществували с други атомни закони. В предишния модел на Ръдърфорд трябваше електроните, движещи се с отрицателен електрически заряд, трябваше да излъчват вид електромагнитно излъчване. Това трябва да бъде изпълнено поради законите на електромагнетизма там. Тази загуба на енергия кара електроните да бъдат редуцирани до своята орбита чрез спирала към центъра. Когато достигнаха центъра, те се срутиха, сблъсквайки се с ядрото.
Това генерира проблем на теория, тъй като не може да се срути с ядрото на атомите, но траекторията на електроните трябва да е различна. Това беше решено с атомния модел на Бор. Това обяснява това електроните обикалят около ядрото в определени орбити, които са разрешени и които имат специфична енергия. Енергията е пропорционална на константата на Планк.
Тези орбити, които споменахме, където електроните се движат, бяха наречени енергийни слоеве или енергийни нива. Тоест енергията, която имат електроните, не винаги е еднаква, но се квантува. Квантовите нива са различните орбити, в които се намират атомите. В зависимост от това в коя орбита се намира във всеки един момент, тя ще има повече или по-малко енергия. Орбитите по-близо до ядрото на атома имат по-голямо количество енергия. От друга страна, колкото повече се отдалечават от ядрото, толкова по-малко енергия.
Модел за енергийно ниво
Този атомен модел на Бор, който предполага, че електроните могат да придобиват или губят енергия само чрез скачане от една орбита на друга, е помогнал да се реши колапса, предложен от модела на Ръдърфорд При преминаване от едно енергийно ниво на друго, то поглъща или излъчва електромагнитно излъчване. Тоест, когато прескочите от по-заредено енергийно ниво на по-малко заредено, освобождавате излишната енергия. И обратно, когато преминава от ниско енергийно ниво към по-високо, то поглъща електромагнитно лъчение.
Тъй като този атомен модел е модификация на модела на Ръдърфорд, характеристиките на малкото централно ядро и с по-голямата част от масата на атома се поддържат. Въпреки че орбитите на електроните не са равни като тези на планетите, може да се каже, че тези електрони се въртят около ядрото си по подобен начин на планетите около Слънцето.
Принципи на атомния модел на Бор

Сега ще анализираме принципите на този атомен модел. Става въпрос за подробно обяснение на споменатия модел и неговата работа.
- Частици, които имат положителен заряд Те са в ниска концентрация в сравнение с общия обем на атома.
- Електроните с отрицателен електрически заряд са тези, които се намират въртящи се около ядрото в кръгови орбити на енергия.
- Има енергийни нива на орбитите, през които електроните циркулират. Те също имат зададен размер, така че няма междинно състояние между орбитите. Те просто преминават от едно ниво на друго.
- Енергията, която притежава всяка орбита, е свързана с нейния размер. Колкото по-далеч е орбитата от ядрото на атома, толкова повече енергия има.
- Енергийните нива имат различен брой електрони. Колкото по-ниско е енергийното ниво, толкова по-малко електрони съдържа. Например, ако сме на ниво едно, ще има до два електрона. На ниво 2 може да има до 8 електрона и т.н.
- Когато електроните се движат от една орбита на друга, те абсорбират или освобождават електромагнитна енергия. Ако преминете от едно по-енергийно ниво на друго по-малко, освобождавате излишната енергия и обратно.
Този модел беше революционен и се опита да придаде стабилност на материала, който предишните модели не притежаваха. Дискретните спектри на емисия и абсорбция на газовете също бяха обяснени с този атомен модел. Това беше първият модел, който въведе концепцията за квантуване или квантуване. Това прави атомния модел на Бор модел, който е по средата между класическата механика и квантовата механика. Въпреки че има и недостатъци, той е предшественик на по-късната квантова механика на Шрьодингер и други учени.
Ограничения и грешки на атомния модел на Бор
Както споменахме, този модел също има някои недостатъци и грешки. На първо място, това не обяснява или дава причини, поради които електроните трябва да бъдат ограничени само до определени орбити. Директно се приема, че електроните имат известен радиус и орбита. Това обаче не е така. Десетилетие по-късно Принципът на несигурност на Хайзенберг опроверга това.
Въпреки че този атомен модел успя да моделира поведението на електроните във водородните атоми, той не беше толкова точен, когато става въпрос за елементи с по-голям брой електрони. Това е модел, който има проблеми с обяснението на ефекта на Земан. Този ефект е това, което може да се види, когато спектралните линии са разделени на две или повече в присъствието на външно и статично магнитно поле.
Друга от грешките и ограниченията, които този модел има, е, че предоставя неправилна стойност за ъгловия момент на орбитата на основното състояние. Всички тези споменати грешки и ограничения правят, че атомният модел на Бор е заменен от квантовата теория години по-късно.
Надявам се, че с тази статия можете да научите повече за атомния модел на Бор и неговите приложения в науката.