
التغيير الكيميائي هو تغيير في المادة يغير تركيبها الكيميائي ، أي أنه يغير خصائصها ، وليس شكلها فقط. هذا يعني أن التغيير الكيميائي ، المعروف أيضًا باسم تفاعل كيميائي أو ظاهرة كيميائية ، ينطوي على تكسير وتشكيل روابط كيميائية في مادة أو مركب واحد لتشكيل مادة أو مركب جديد. هناك العديد التغيرات الكيميائية في جميع أنحاء العالم.
لهذا السبب ، سنخصص هذه المقالة لنخبرك ما هي التغييرات الكيميائية الرئيسية الموجودة ومثال عليها.
ما هي التغيرات الكيميائية؟

عند وجود مادتين أو أكثر (تسمى المواد المتفاعلة أو المتفاعلات) الخضوع لتفاعل كيميائي ، وتغيير تركيبها الكيميائي في العملية والقدرة على الاستهلاك (تفاعلات ماصة للحرارة) أو إطلاق (تفاعلات طاردة للحرارة) طاقة ، تنتج مادتين أو أكثر (تسمى منتجًا). تعتبر بعض التفاعلات الكيميائية خطرة على البشر لأنها قد تحتوي على مركبات سامة أو مسببة للتآكل أو تنتج عنها. ردود الفعل الأخرى ، مثل بعض التفاعلات الطاردة للحرارة ، يمكن أن تسبب انفجارات.
في الصناعة الكيميائية ، يتم إنتاج العديد من المواد التي نستخدمها في حياتنا اليومية من خلال تفاعلات كيميائية خاضعة للرقابة. تحدث بعض التفاعلات بشكل عفوي ، والبعض الآخر يجب أن ينتج عن طريق البشر في المصانع أو المختبرات الكيميائية. يستغرق التفاعل الكيميائي مقدارًا معينًا من الوقت لحدوثه. اعتمادًا على طبيعة المواد المتفاعلة والظروف التي يحدث فيها التفاعل.
لذلك ، تشمل العوامل التي تؤثر على معدل التفاعلات الكيميائية بشكل عام ما يلي:
- ترتفع درجة الحرارة. تميل الزيادة في درجة الحرارة إلى زيادة معدل التفاعل الكيميائي.
- زيادة الضغط. تؤدي زيادة الضغط بشكل عام إلى زيادة معدل التفاعل الكيميائي. يحدث هذا عادة عندما تتفاعل المواد الحساسة لتغيرات الضغط ، مثل الغازات. في حالة السوائل والمواد الصلبة ، لا تسبب تغيرات الضغط تغيرات كبيرة في معدلات تفاعلها.
- حالة تجميع الكاشف. تتفاعل المواد الصلبة بشكل عام بشكل أبطأ من السوائل أو الغازات ، على الرغم من أن السرعة تعتمد أيضًا على تفاعل كل مادة.
- استخدام محفز. إنها مواد تستخدم لزيادة سرعة التفاعلات الكيميائية. لا تتداخل هذه المواد مع التفاعل ، فهي تتحكم فقط في معدل حدوث التفاعل. هناك أيضًا مواد تسمى المثبطات ، والتي تستخدم بنفس الطريقة ولكن لها تأثير معاكس ، مما يؤدي إلى إبطاء التفاعل.
- الطاقة الضوئية. تسرع بعض التفاعلات الكيميائية عندما يسقط الضوء عليها.
- تركيز الكاشف. تحدث معظم التفاعلات الكيميائية بشكل أسرع إذا كانت تركيزات المواد المتفاعلة عالية.
أمثلة على التغييرات الكيميائية
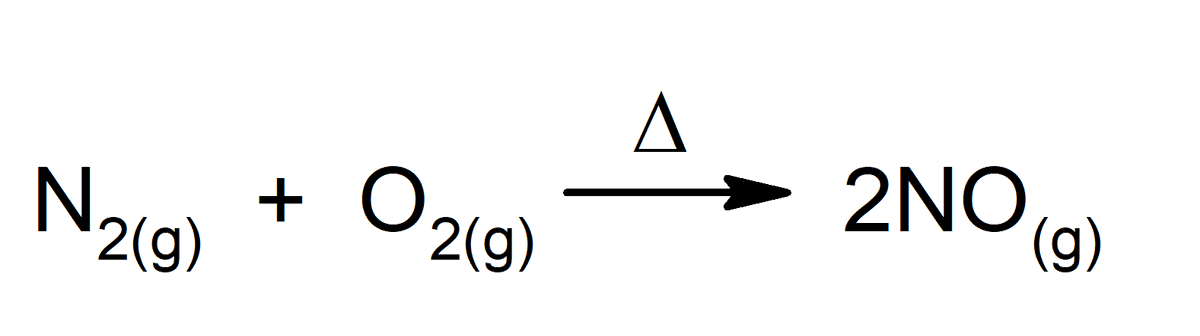
أي تفاعل كيميائي هو مثال ممتاز للتغير الكيميائي ، حتى تلك التي تحدث داخل أجسامنا. بعض الأمثلة هي:
- عمليه التنفس. هذه عملية بيولوجية معدلة كيميائيًا يتم فيها أخذ الأكسجين من الهواء واستخدامه للتفاعل مع الجلوكوز الذي نحصل عليه من الطعام ، مما ينتج عنه مستويات عالية من الطاقة الكيميائية (ATP) وكميات كبيرة من نفايات ثاني أكسيد الكربون (CO2). تفرز.
- أمطار حمضية. يحدث في بيئات شديدة تلوث الهواء. عادة ما يكون نتيجة لتغير كيميائي بين المياه المخزنة في السحب والغازات الأخرى المنتشرة في الهواء ، والتي ينتج عن محتواها من أكسيد الكبريت أو أكسيد النيتروجين حمض الكبريتيك أو حمض النيتريك الذي يسقط مع مياه الأمطار لتكوين الملح. يكون التفاعل الذي يحدث داخل البطارية بين الحمض والمعدن. على سبيل المثال ، تنتج البطارية التي تستخدم الرصاص وحمض الكبريتيك كبريتات الرصاص (II) ، وهو ملح أبيض. تحلل الأوزون. تنقسم جزيئات الأوزون إلى جزيئات أكسجين تحت تأثير نوع من الضوء.
التغيير الكيميائي والتغيير المادي

التغييرات الفيزيائية للمادة لا تغير تركيبها ، أي أنها لا تغير التركيب الكيميائي للمادة ، لذلك لا يمكن تكسير المواد أو تشكيلها بالتغيرات الفيزيائية. يغير التغيير المادي ببساطة الخصائص الفيزيائية للمادة ، مثل الشكل والكثافة وحالة التجميع (صلب ، سائل ، غاز). التغييرات الجسدية ، من ناحية أخرى ، عادة ما تكون قابلة للعكس لأنها تغير شكل أو حالة المادة ، ولكن ليس تكوينها.
على سبيل المثال ، عندما يغلي الماء ، يمكننا تحويل السائل إلى غاز ، لكن البخار الناتج لا يزال مكونًا من جزيئات الماء. على العكس من ذلك ، إذا قمنا بتجميد الماء ، فإنه يصبح صلبًا ، لكنه يظل نفس المادة كيميائيًا.
مثال آخر هو الغاز المسال الذي نستخدمه في ولاعات السجائر لدينا ، عادةً ما يتحول البيوتان (C4H10) أو البروبان (C3H8) الذي يتحول إلى سائل عند الضغط المرتفع ، ولكنه لا يغير تركيبته الكيميائية.
يغير التغيير الكيميائي ترتيب وترابط الذرات في مادة ما بحيث تتحد بطريقة مختلفة ، مما ينتج عنه مادة مختلفة عن المادة الأصلية. عندما يحدث تغيير كيميائي ، ينتهي بك الأمر دائمًا بنفس الكمية من المادة التي بدأت بها ، حتى لو كانت بنسب مختلفة ، لأنه لا يمكن إنشاء المادة أو تدميرها ، بل تتحول فقط.
على سبيل المثال ، إذا تفاعلنا مع الماء (H2O) والبوتاسيوم (K) ، فسنحصل على مادتين جديدتين: هيدروكسيد البوتاسيوم (KOH) وغاز الهيدروجين (H2). هذا هو رد الفعل الذي يطلق بشكل عام الكثير من الطاقة وبالتالي فهو خطير للغاية.
أمثلة على التغيرات الكيميائية في المادة
خبز البسكويت أو الكعك
الأشياء الشائعة مثل ملفات تعريف الارتباط ، والكعك ، والكب كيك ، وما إلى ذلك. يخفي تفاعلًا كيميائيًا يسمى التخمير ، والذي فيه يرتفع العجين بسبب الغازات التي تنتجها الخميرة. في صناعة الخبز ، تحول الخميرة النشا إلى جلوكوز.
الهضم
يعد هضم الطعام مثالًا واضحًا على التغيير الكيميائي للمادة من خلال التحلل المائي (انهيار المادة العضوية بفعل الماء). الطعام الذي نأكله على شكل فواكه وخضروات ولحوم وما إلى ذلك ، يمرون بعملية خلط مع العصائر المعدية لامتصاص العناصر الغذائية بشكل أفضل وتحويلها إلى مواد مختلفة حسب احتياجات الكائن الحي.
في نفس العملية ، يتم التخلص من العناصر الزائدة أو السموم من الكائن الحي بطريقة مختلفة عن الطريقة الأصلية ؛ على شكل براز ، بول ، عرق ، إلخ.
البكر
التخمير هو عملية تقويضية تتفكك فيها جزيئات الجلوكوز بسبب نقص الأكسجين. بعض المشروبات الكحولية التي يتم الحصول عليها من خلال عملية التخمير هي عصير التفاح والبيرة والنبيذ الغازي ، وهذا الأخير هو أحد المشروبات الأقل شهرة في العالم. يتم الحصول على Pulque من نبات الأغاف من خلال عملية حرفيةل ، حيث يعتبر نضج المادة هو المفتاح للحصول على المنتج النهائي ، وهو أبيض وحامض ولزج ، مع نكهة محددة للغاية لا تناسب أي حنك.
يحدث التخمير أيضًا أثناء صنع الخبز واللبن والجبن وغيرها.
حلوى
يعتبر الكراميل مثالًا أساسيًا للتغير الكيميائي في المادة ، حيث يتحول السكر الأبيض الصلب ، الذي يتم تسخينه لبضع دقائق ، إلى مادة لزجة بلون الكهرمان مع رائحة لطيفة. بمعنى آخر ، يتم إنشاء منتج مختلف تمامًا عن المنتج الأصلي.
آمل أن تتمكن من خلال هذه المعلومات من معرفة المزيد عن التغيرات الكيميائية وأمثلةها.