У світі фізики існує галузь, яка відповідає за вивчення перетворень, що утворюються внаслідок нагрівання та роботи в системі. Йдеться про термодинаміка. Це розділ фізики, який відповідає за вивчення всіх перетворень, які є лише результатом процесів, що включають зміни змінних стану як температури, так і енергії на макроскопічному рівні.
У цій статті ми розповімо вам все, що вам потрібно знати про термодинаміку та принципи термодинаміки.
ключові особливості
Якщо ми робимо аналіз класичної термодинаміки, то бачимо, що вона базується на концепції макроскопічної системи. Ця система є не що інше, як частина фізичної або концептуальної маси, яка відокремлена від зовнішнього середовища. Для кращого вивчення термодинамічних систем завжди передбачається, що це фізична маса, яка не порушується обміном енергії із зовнішньою екосистемою.
Стан макроскопічної системи, що є в умовах рівноваги це визначається величинами, які називаються термодинамічними змінними. Всі ці змінні нам відомі і стосуються температури, тиску, об’єму та хімічного складу. Усі ці змінні визначають системи та їх рівновагу. Основні позначення хімічної термодинаміки були встановлені завдяки застосованому міжнародному союзу. За допомогою цих одиниць закон термодинаміки можна краще опрацювати та пояснити.
Однак існує розділ термодинаміки, який не вивчає рівновагу, але відповідає за аналіз термодинамічних процесів, які в основному характеризуються не маючи здатності стабільно досягати рівноважних умов.
Закони
Принципи були засуджені протягом XNUMX століття Ісою тих, хто Вони відповідають за регулювання всіх перетворень та їх прогресу. Вони також аналізують реальні межі, щоб мати справжнє уявлення. Вони є аксіомами, які неможливо довести, але їх неможливо довести на основі досвіду. Кожна теорія термодинаміки базується на цих принципах. Ми можемо розрізнити 3 основні принципи плюс принцип, але це той, який визначає температуру, і який мається на увазі в інших 3 принципах.
Нульовий закон
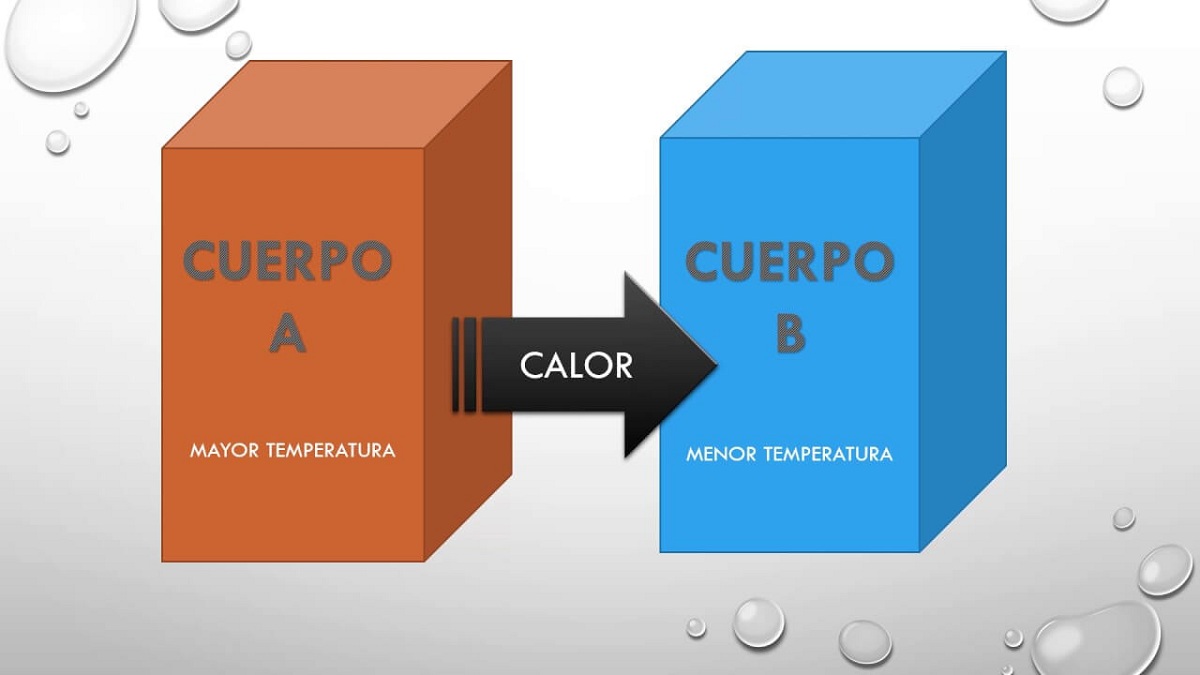
Ми збираємось описати, що таке цей нульовий закон, який першим описує температуру, яка передбачається в інших принципах. Коли дві системи взаємодіють між собою і перебувають у тепловій рівновазі, вони поділяють деякі властивості. Ці властивості, якими вони діляться між собою, можна виміряти і надати числове значення. Як результат, якщо дві системи знаходяться в рівновазі з третьою, вони будуть у рівновазі одна з одною, а властивість, якою ділиться, - це температура.
Отже, цей принцип, але просто говорить, що якщо тіло A знаходилось у рівновазі з тілом B, і це тіло B знаходитиметься в тепловій рівновазі з тілом C, тоді тіла A і C також будуть в рівновазі тепловий. Цей принцип пояснює той факт, що два тіла при різних температурах можуть обмінюватися теплою між собою. Рано чи пізно обидва тіла досягають однакової температури, тому вони знаходяться в повній рівновазі.
Перший закон термодинаміки
Коли тіло контактує з тілом, яке холодніше, відбувається трансформація, що призводить до стану рівноваги. Цей стан рівноваги заснований на тому, що температура двох тіл однакова, оскільки посилюється передача енергії між гарячим тілом для холодного тіла. Для того, щоб пояснити це явище, вчені припустили, що гаряча речовина, яка присутня у більшій кількості, пропускає більш холодне тіло. Вважалося, що рідина може рухатися по масі, щоб мати можливість обмінюватися теплом.
Цей принцип відповідає за визначення тепла як форми енергії. Це не матеріальна речовина. Таким чином, можна було б показати, що тепло, яке вимірюється калоріями, а робота, яка вимірюється в джоулях, рівноцінна. Тому ми сьогодні це знаємо 1 калорія становить приблизно 4,186 джоулів.
Можна сказати, що перший принцип термодинаміки - це принцип збереження енергії. Кількість енергії в тепловій машині перетворюється на роботу, і її може побачити будь-яка машина, яка може виробляти таку роботу, не споживаючи енергії. Цей перший принцип ми можемо встановити так: варіація внутрішньої енергії замкнутої термодинамічної системи дорівнює різниці, яка існує між теплом, яке подається в систему, і роботою, яку ця система виконує в навколишньому середовищі.
Другий закон термодинаміки
Це на початку стверджує, що неможливо зробити циклічну машину, яка лише призводить до передачі тепла від холодного тіла до теплого. Можна сказати, що неможливо здійснити трансформацію, результат якої буде лише це перетворення тепла, яке ми виділили з одного джерела, в механічну роботу.
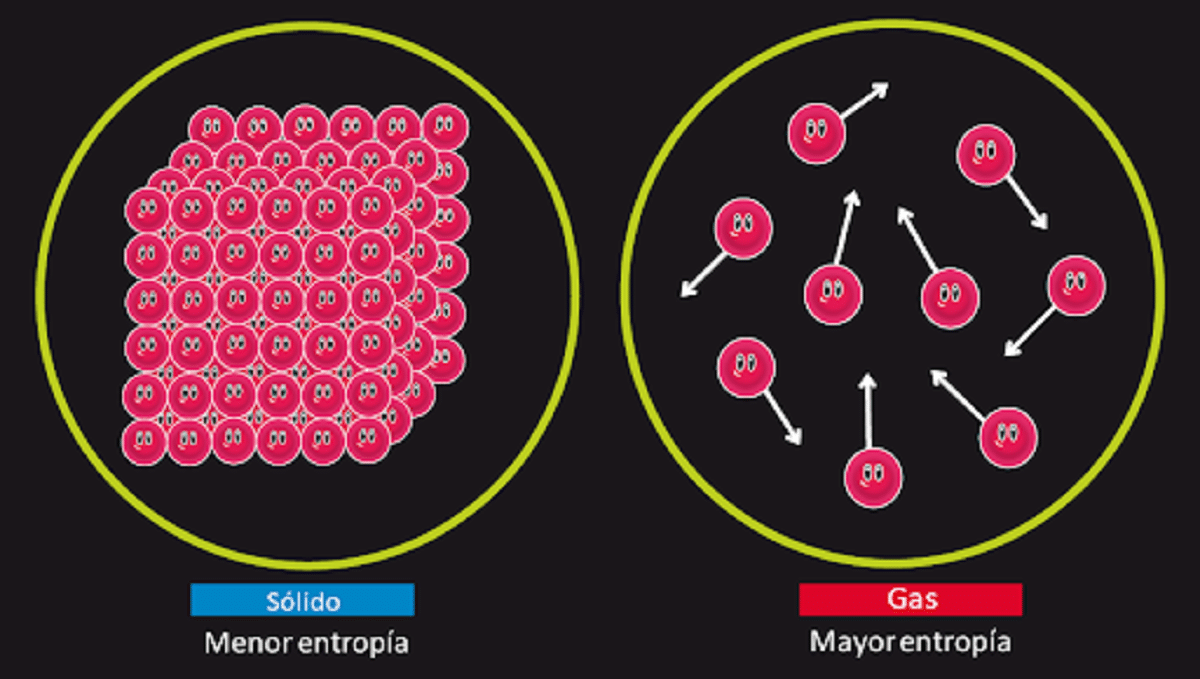
Цей принцип відповідає за заперечення можливості існування відомого вічного руху другого виду. Ми знаємо, що ентропія системи залишається ізольованою незмінною, коли відбувається оборотне перетворення. Ми також знаємо, що вона збільшується, коли відбувається незворотна трансформація.
Третій закон термодинаміки
Цей останній принцип тісно пов'язаний з другим і розглядається як його наслідок. Цей принцип стверджує, що абсолютного буття неможливо досягти в кольорі за допомогою кінцевої кількості перетворень. Ми знаємо, що абсолютний нуль - це не більше мінімальної температури, якої можна досягти. В одиницях Кельвіна, ми знаємо, що воно дорівнює 0, але в градусах Цельсія воно має значення -273.15 градусів.
У ньому також зазначено, що ентропія для твердої речовини, що є абсолютно кристалічною з температурою 0 кельвіна, дорівнює 0. Це означає, що не було б ентропії, тому система була б повністю стабільною. Енергія звільнення, перекладу та обертання частинок, що її складають, була б нічим при температурі 0 кельвіна.
Я сподіваюся, що завдяки цій інформації ви зможете дізнатись більше про термодинаміку та основні принципи.