
Після знайомства Атомна модель Томсона, який вважав, що електрони перебувають у позитивно зарядженому середовищі, більш досконала модель, відома як Атомна модель Резерфорда. Вченим, відповідальним за цей новий науковий прогрес, був Ернест Резерфорд. Він народився 20 серпня 1871 року та помер 19 жовтня 1937 року. За своє життя він зробив великий внесок у хімію та світ науки загалом.
Тому ми збираємося присвятити цю статтю, щоб розповісти вам все, що вам потрібно знати про атомну модель Резерфорда.
Експеримент із золотого листя
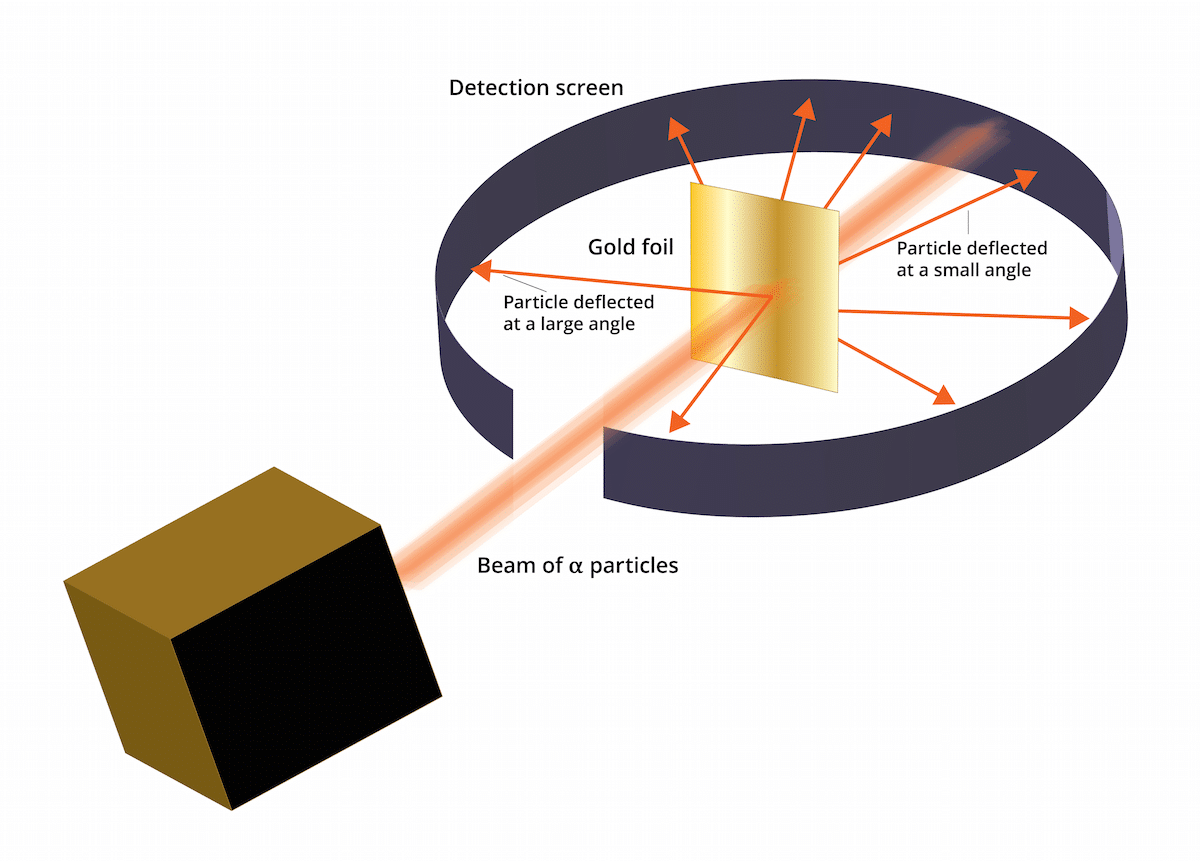
Стара модель Томсона говорила, що електрони знаходились у позитивно зарядженому середовищі. У 1909 р. Ернест Резерфорд у супроводі двох асистентів на ім'я Гейгер і Марсден провів дослідження, відоме як експеримент "Золоте листя", де вони могли перевірити, що Усім відомий «пудинг із ізюму» був помилковим. І полягає в тому, що цей новий експеримент зміг показати, що атом мав структуру з сильним позитивним зарядом. Цей експеримент або може допомогти відновити деякі висновки, які в підсумку були представлені як атомна модель Резерфорда в 1911 році.
Експеримент, відомий як “Лист золота”, не був унікальним, але їх проводили між 1909 і 1913 рр. Для цього вони використовували фізичні лабораторії Манчестерського університету. Ці експерименти мали велике значення, оскільки з їх результатів можна було зробити нові висновки, що призвели до революційної атомної моделі.
Цей експеримент полягав у наступному: тонкий лист золота товщиною лише 100 нм потрібно було засипати великою кількістю альфа-частинок. Цими альфа-частинками були і іони. Тобто атоми, які не мають електронів, отже вони мали лише протони та нейтрони. Маючи нейтрони і протони, загальний заряд атома був позитивним. Цей експеримент головним чином мав на меті підтвердити правильність моделі Томсона. Якщо ця модель мала рацію, альфа-частинки повинні були проходити через атоми золота по прямій.
Для вивчення відхилення, спричиненого альфа-частинками, навколо тонкої золотої фольги довелося розмістити флуоресцентний фільтр із сульфіду цинку. Результатом цього експерименту є те, що було помічено, що деякі частинки могли проходити через атоми золота аркуша прямолінійно. Однак деякі з цих альфа-частинок були відхилені у випадкових напрямках.
Висновки експерименту «Золоте листя»

З огляду на цей факт, не вдалося підтвердити те, що розглядаються попередніми атомними моделями. І саме в тому, що ці атомні моделі вказували на те, що позитивний заряд розподілявся рівномірно в атомах, і це полегшило б його перетин, оскільки його заряд не був би таким сильним у певній точці.
Результати цього експерименту із Золотим листям були абсолютно несподіваними. Це змусило Резерфорда думати, що у атома є центр із сильним позитивним зарядом, який виникає при альфа-частинці спробувати видати його відхиленим центральною структурою. Для того, щоб встановити більш надійне джерело, частинки розглядали в кількості тих, що відбивались, а тих, що ні. Завдяки такому виділенню частинок вдалося визначити розмір ядра порівняно з орбітою електронів, які знаходяться навколо нього. Можна також зробити висновок, що більша частина простору атома порожня.
Видно було, що деякі альфа-частинки відхилялись золотою фольгою. Деякі з них відхилялися лише під дуже малими кутами. Це допомогло зробити висновок, що позитивний заряд на атомі розподілений не рівномірно. Тобто позитивний заряд розташований на атомі концентровано в дуже малому обсязі простору.
Дуже мало альфа-частинок відходило назад. Це відхилення вказує на те, що зазначені частинки могли відскочити. Завдяки всім цим новим міркуванням атомна модель Резерфорда могла бути створена за допомогою нових ідей.
Атомна модель Резерфорда

Ми збираємось вивчити, які принципи атомної моделі Резерфорда:
- Частинки, які мають позитивний заряд усередині атома вони розташовані в дуже малому обсязі, якщо порівняти його із загальним обсягом згаданого атома.
- Майже вся маса, яку має атом, знаходиться в тому згаданому малому обсязі. Цю внутрішню масу називали ядром.
- Електрони, що мають негативні заряди виявляються обертовими навколо ядра.
- Електрони обертаються з високою швидкістю, коли вони знаходяться навколо ядра, і роблять це круговими шляхами. Ці траєкторії називали орбітами. Пізніше буду вони відомі як орбіталі.
- І ті електрони, які були негативно заряджені, і ядро самого позитивно зарядженого атома завжди утримуються разом завдяки електростатичній силі притягання.
Прийняття та обмеження атомної моделі Резерфорда
Як і слід було очікувати, ця нова модель передбачила абсолютно нову панораму атома в науковому світі. Завдяки цій атомній моделі багато пізніших вчених могли вивчити і визначити кількість електронів, яку має кожен елемент періодичної системи. Крім того, можуть бути зроблені нові відкриття, які допоможуть пояснити функціонування атома найпростішим способом.
Однак ця модель також має деякі обмеження та помилки. Хоча це був прорив у світі фізики, вони не були ні досконалою, ні повноцінною моделлю. І чи є це відповідно до законів Ньютона і важливого аспекту законів Максвелла, ця модель не могла пояснити деякі речі:
- Він не міг пояснити, як негативні заряди могли утримуватися в ядрі. Відповідно до електронної гомілки, позитивні заряди повинні відштовхувати один одного.
- Ще одне протиріччя було щодо основних законів електродинаміки. Якщо вважати, що електрони з позитивним зарядом обертаються навколо ядра, вони повинні випромінювати електромагнітне випромінювання. При випромінюванні цього випромінювання витрачається енергія, щоб електрони руйнувалися в ядрі. Отже, смугаста атомна модель не може пояснити стабільність атома.
Я сподіваюся, що з цією інформацією ви зможете дізнатись більше про атомну модель Резерфорда.