Fizik dünyasında ısının ürettiği dönüşümleri incelemek ve bir sistem içinde çalışmakla sorumlu bir dal vardır. Hakkında termodinamik. Makroskopik düzeyde hem sıcaklık hem de enerjinin durum değişkenlerindeki değişiklikleri içeren süreçlerin sonucu olan tüm dönüşümleri incelemekten sorumlu olan bir fizik dalıdır.
Bu yazıda size termodinamik ve termodinamiğin prensipleri hakkında bilmeniz gereken her şeyi anlatacağız.
temel özellikleri
Klasik termodinamiğin bir analizini yaparsak, bunun makroskopik sistem kavramına dayandığını görürüz. Bu sistem, dış çevreden ayrılmış fiziksel veya kavramsal kütlenin bir kısmından başka bir şey değildir. Termodinamik sistemleri daha iyi incelemek için, her zaman dış ekosistemle enerji alışverişinden rahatsız olmayan fiziksel bir kütle olduğu varsayılır.
Makroskopik bir sistemin durumu nedir denge koşullarında termodinamik değişkenler adı verilen niceliklerle belirtilir. Tüm bu değişkenleri biliyoruz ve bunlar sıcaklık, basınç, hacim ve kimyasal bileşimdir. Tüm bu değişkenler, sistemleri ve dengelerini tanımlayan şeydir. Kimyasal termodinamikte sahip olunan ana notasyonlar, uygulanan uluslararası birlik sayesinde oluşturulmuştur. Bu birimlerle termodinamiğin yasasını çalışmak ve daha iyi açıklamak mümkündür.
Bununla birlikte, dengeyi incelemeyen, ancak esas olarak karakterize edilen termodinamik süreçleri analiz etmekten sorumlu bir termodinamik dalı vardır. denge koşullarını istikrarlı bir şekilde elde etme yeteneğine sahip olmamak.
yasalar
XNUMX. yüzyılda İsa'da ilkeler kınandı. Tüm dönüşümleri ve ilerlemelerini düzenlemekten sorumludurlar. Ayrıca doğru bir kavrayışa sahip olmak için gerçek sınırların ne olduğunu da analiz ederler. Kanıtlanamayan ancak deneyime dayalı olarak kanıtlanamayan aksiyomlardır. Her termodinamik teorisi bu ilkelere dayanmaktadır. 3 temel ilke artı ilkeyi ayırt edebiliriz, ancak bu, sıcaklığı tanımlayan ve diğer 3 ilkede örtük olan şeydir.
Sıfır kanun
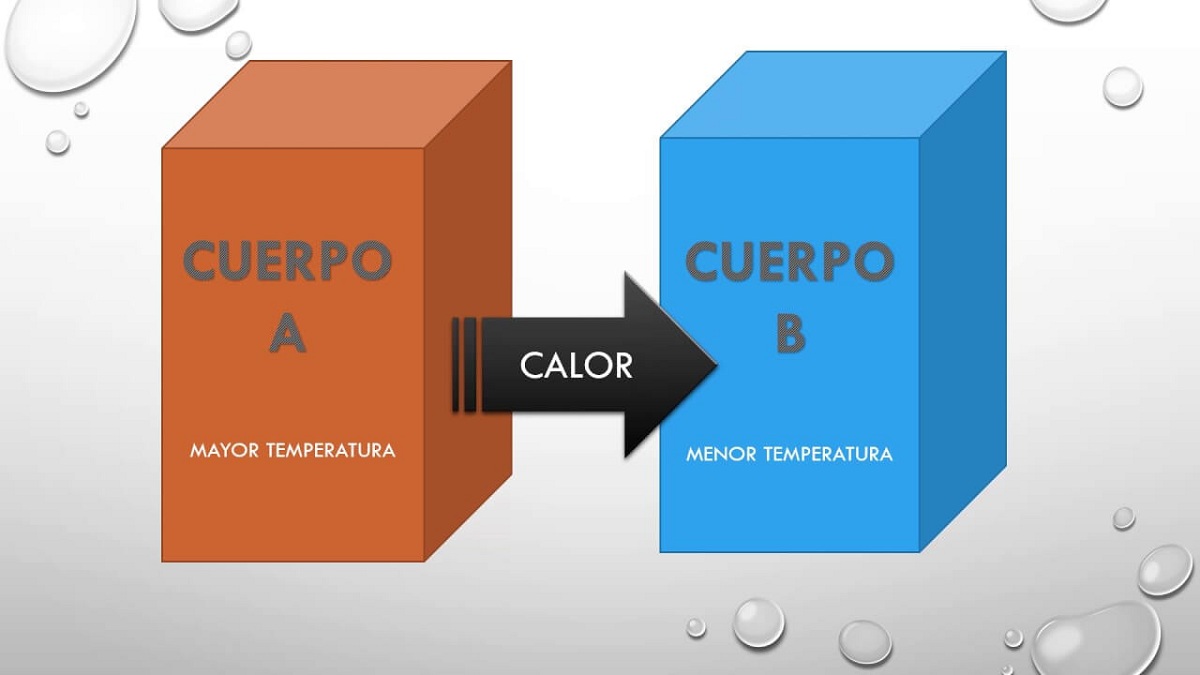
İlkelerin geri kalanında örtük olan sıcaklığı tanımlayan ilk şey olan bu sıfır yasasının ne olduğunu açıklayacağız. İki sistem birbirleriyle etkileşime girdiğinde ve termal dengede olduklarında bazı özellikleri paylaşırlar. Birbirleriyle paylaştıkları bu özellikler ölçülebilir ve sayısal bir değer verilebilir. Sonuç olarak, iki sistem bir üçüncüsü ile dengede ise, birbirleriyle denge içinde olacaklar ve paylaşılan özellik sıcaklıktır.
Bu nedenle, bu ilke, ancak basitçe şunu belirtir: bir A gövdesi, bir B gövdesi ile dengede idi ve bu B gövdesi, bir C gövdesi ile termal dengede olacak, sonra A ve C gövdeleri de dengede olacak termal. Bu ilke, farklı sıcaklıklardaki iki cismin birbiriyle ısı alışverişi yapabildiğini açıklar. Er ya da geç her iki cisim de aynı sıcaklığa ulaşır, bu yüzden tam denge içindedirler.
Termodinamiğin Birinci Yasası
Bir vücut daha soğuk bir bedenle temas ettirildiğinde, bir denge durumuna yol açan bir dönüşüm gerçekleşir. Bu denge durumu, soğuk cisim için sıcak cisim arasında bir enerji transferinin artması nedeniyle iki cismin sıcaklığının eşit olmasına dayanır. Bu fenomeni açıklamak için bilim adamları, daha büyük miktarlarda bulunan sıcak bir maddenin daha soğuk bir vücuttan geçtiğini varsaydılar. Isı alışverişi yapabilmek için kütle içinde hareket edebilen bir akışkan düşünülüyordu.
Bu ilke, ısının bir enerji biçimi olarak tanımlanmasından sorumludur. Maddi bir madde değildir. Bu şekilde, kalori ile ölçülen ısının ve joule cinsinden ölçülen işin eşdeğer olduğu gösterilebilir. Bu nedenle, bugün biliyoruz ki 1 kalori yaklaşık 4,186 joule'dir.
Termodinamiğin birinci ilkesinin enerjinin korunumu ilkesi olduğu söylenebilir. Bir ısı motorundaki bir miktar enerji işe dönüştürülür ve enerji tüketmeden böyle bir işi üretebilen herhangi bir makine tarafından görülebilir. Bu ilk prensibi şöyle kurabiliriz: Kapalı bir termodinamik sistemin iç enerjisinin değişimi, sisteme sağlanan ısı ile söz konusu sistemin çevrede yaptığı iş arasında var olan farka eşittir.
Termodinamiğin ikinci yasası
Bu, başlangıçta sadece ısının soğuk bir vücuttan sıcak bir vücuda aktarılmasıyla sonuçlanan döngüsel bir makine yapmanın imkansız olduğunu belirtir. Sonucu sadece olacak bir dönüşümün gerçekleştirilebilmesinin imkansız olduğunu söyleyebiliriz. tek bir kaynaktan çıkardığımız ısıyı mekanik işe dönüştürmek.
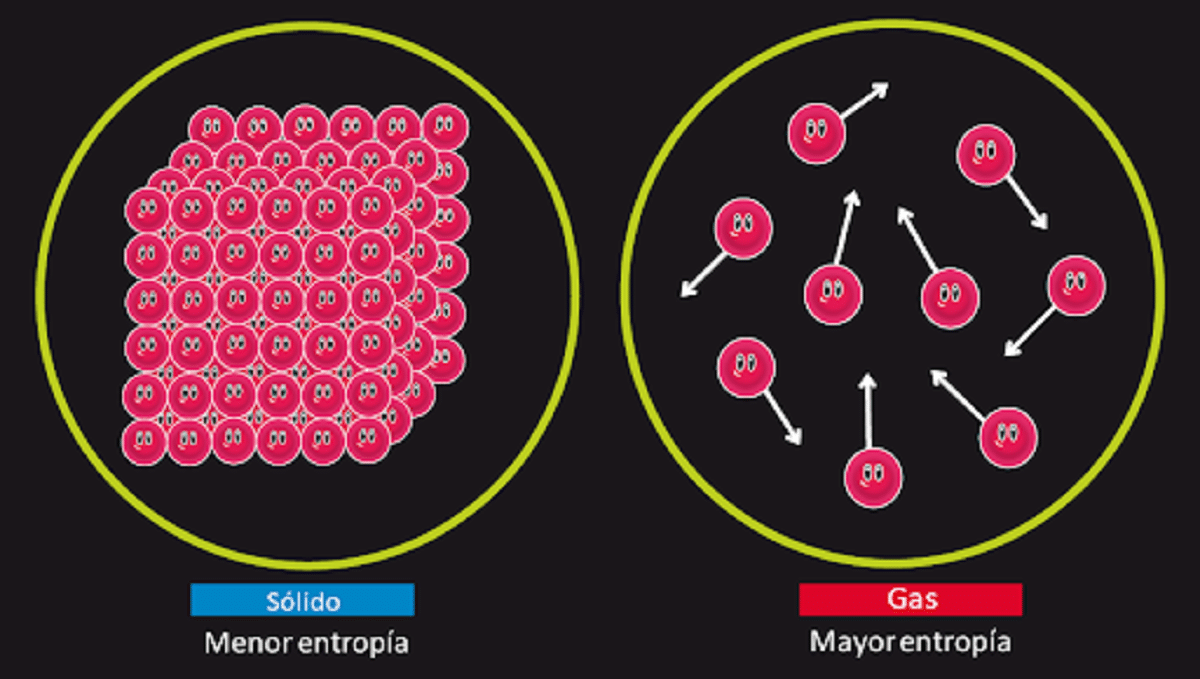
Bu ilke, ikinci türün bilinen sürekli hareketinin var olma olasılığını reddetmekten sorumludur. Biliyoruz ki entropi bir sistemin geri dönüşümlü bir dönüşüm gerçekleştiğinde değişmeden izole kalır. Geri dönüşü olmayan bir dönüşüm gerçekleştiğinde arttığını da biliyoruz.
Termodinamiğin üçüncü yasası
Bu son ilke, ikinciyle yakından ilgilidir ve bunun bir sonucu olarak kabul edilir. Bu ilke, mutlak varlığın renkli olarak sınırlı sayıda dönüşümle elde edilemeyeceğini doğrular. Mutlak sıfırın ulaşılabilen minimum sıcaklıktan fazla olmadığını biliyoruz. Birimlerde Kelvin'in 0 olduğunu biliyoruz, ancak Santigrat derece olarak -273.15 derece değerine sahip.
Ayrıca, 0 kelvin sıcaklıkta mükemmel kristalli bir katının entropisinin 0'a eşit olduğunu belirtir. Bu, entropi olmayacağı anlamına gelir, böylece sistem tamamen kararlı olur. Onu oluşturan parçacıkların serbest kalma, öteleme ve dönme enerjisi 0 kelvin sıcaklıkta hiçbir şey olmaz.
Umarım bu bilgilerle termodinamik ve temel prensipler hakkında daha fazla bilgi edinebilirsiniz.