
Şüphesiz sen hiç gördün Bohr atom modeli. Bu bilim adamının bilim için, özellikle elektromanyetizma ve elektrokimya için yaptığı oldukça önemli bir keşiftir. Önceden Rutherford'un oldukça devrimci ve çok başarılı olan modeli vardı, ancak Maxwell ve Newton gibi diğer atom yasalarıyla bazı çatışmalar vardı.
Bu yazıda Bohr'un atom modeli hakkında bilmeniz gereken her şeyi ve konuyla ilgili herhangi bir şüpheyi açıklığa kavuşturmak için ayrıntılarını size anlatacağız.
Çözmesine yardımcı olduğu sorunlar
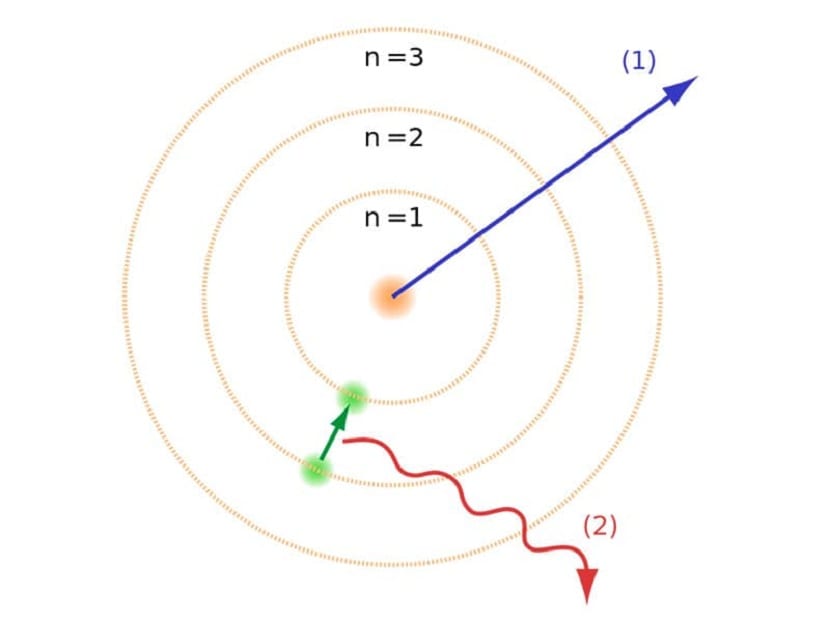
Makalenin başında da bahsettiğimiz gibi, bu atom modeli diğer atom kanunlarıyla var olan bazı çatışmaların çözülmesine yardımcı oldu. Önceki Rutherford modelinde, Negatif elektrik yükü ile hareket eden elektronların bir tür elektromanyetik radyasyon yayması gerekiyordu. Bu, oradaki elektromanyetizma yasaları nedeniyle yerine getirilmelidir. Bu enerji kaybı, elektronların merkeze doğru spiral yaparak yörüngelerine indirgenmesine neden olur. Merkeze ulaştıklarında çöktüler, çekirdekle çarpıştılar.
Bu, atomların çekirdeğiyle çökemediği için teoride bir sorun yarattı, ancak elektronların yörüngesinin farklı olması gerekiyordu. Bu Bohr atom modeliyle çözüldü. Bunu açıklıyor elektronlar, izin verilen ve belirli bir enerjiye sahip olan belirli yörüngelerde çekirdeğin etrafında yörüngede dönerler. Enerji, Planck sabitiyle orantılıdır.
Elektronların hareket ettiği yerde bahsettiğimiz bu yörüngelere enerji katmanları veya enerji seviyeleri deniyordu. Yani, elektronların sahip olduğu enerji her zaman aynı değildir, ancak nicelendirilir. Kuantum seviyeleri, atomların bulunduğu farklı yörüngelerdir. Herhangi bir anda hangi yörüngede olduğuna bağlı olarak, az ya da çok enerjiye sahip olacaktır. Atomun çekirdeğine daha yakın yörüngeler daha büyük miktarda enerjiye sahiptir. Öte yandan, çekirdekten ne kadar uzaklaşırsa, enerji o kadar az olur.
Enerji seviyesi modeli
Elektronların ancak bir yörüngeden diğerine atlayarak enerji kazanabileceklerini veya kaybedebileceklerini ima eden bu Bohr atom modeli, Rutherford'un modelinin önerdiği çöküşün çözülmesine yardımcı oldu. Bir enerji seviyesinden diğerine geçerken, elektromanyetik radyasyonu emer veya yayar. Yani, daha yüklü bir enerji seviyesinden daha az yüklü bir seviyeye atladığınızda, fazla enerjiyi serbest bırakırsınız. Tersine, düşük enerji seviyesinden daha yüksek bir enerji seviyesine geçtiğinde, elektromanyetik radyasyonu emer.
Bu atom modeli Rutherford modelinin bir modifikasyonu olduğundan, küçük merkezi çekirdeğin özellikleri ve atomun kütlesinin çoğu korunur. Elektronların yörüngeleri gezegenlerinki gibi düz olmasa da, bu elektronların Güneş etrafındaki gezegenlere benzer şekilde çekirdek etrafında döndükleri söylenebilir.
Bohr'un atom modeli ilkeleri

Şimdi bu atom modelinin prensiplerini analiz edeceğiz. Söz konusu modelin ve işleyişinin ayrıntılı bir açıklaması hakkındadır.
- Pozitif yüklü parçacıklar Atomun toplam hacmine kıyasla düşük konsantrasyondadırlar.
- Negatif elektrik yüklü elektronlar, çekirdek etrafında dairesel enerji yörüngelerinde dönerken bulunanlardır.
- Elektronların dolaştığı yörüngelerin enerji seviyeleri vardır. Ayrıca belirli bir boyuta sahiptirler, bu nedenle yörüngeler arasında ara durum yoktur. Sadece bir seviyeden diğerine giderler.
- Her bir yörüngenin sahip olduğu enerji, boyutuyla ilgilidir. Yörünge atomun çekirdeğinden ne kadar uzaksa, o kadar fazla enerjiye sahiptir.
- Enerji seviyeleri farklı sayıda elektrona sahiptir. Enerji seviyesi ne kadar düşükse, içerdiği elektron sayısı o kadar azdır. Örneğin, birinci seviyedeysek, iki adede kadar elektron olacaktır. 2. seviyede 8'e kadar elektron olabilir, vb.
- Elektronlar bir yörüngeden diğerine hareket ettiklerinde, elektromanyetik enerjiyi emer veya serbest bırakırlar. Bir daha enerjisel seviyeden diğerine daha az giderseniz, fazla enerjiyi serbest bırakırsınız ve bunun tersi de geçerlidir.
Bu model devrim niteliğindeydi ve önceki modellerin sahip olmadığı malzemeye bir denge sağlamaya çalıştı. Gazların ayrık emisyon ve absorpsiyon spektrumları da bu atom modeli ile açıklanmıştır. Niceleme veya niceleme kavramını tanıtan ilk modeldi. Bu, Bohr'un atom modelini klasik mekanik ile kuantum mekaniği arasında yarı yolda olan bir model yapar. Ayrıca eksiklikleri olmasına rağmen, Schrödinger ve diğer bilim adamlarının daha sonraki kuantum mekaniği için bir öncü modeldi.
Bohr atom modelinin sınırlamaları ve hataları
Bahsettiğimiz gibi, bu modelin de bazı eksiklikleri ve hataları var. Her şeyden önce, elektronların neden yalnızca belirli yörüngeler ile sınırlandırılması gerektiğini açıklamıyor veya nedenlerini açıklamıyor. Doğrudan elektronların bilinen bir yarıçap ve yörüngeye sahip olduğunu varsayar. Ancak bu öyle değil. On yıl sonra Heisenberg'in belirsizlik ilkesi bunu çürüttü.
Bu atomik model, hidrojen atomlarındaki elektronların davranışını modelleyebilmesine rağmen, daha yüksek sayıda elektrona sahip elementler söz konusu olduğunda o kadar kesin değildi. Bu bir modeldir Zeeman etkisini açıklamada sorun yaşıyor. Bu etki, spektral çizgiler bir harici ve statik manyetik alan varlığında ikiye veya daha fazlasına bölündüğünde görülebilen şeydir.
Bu modelin sahip olduğu hatalardan ve sınırlamalardan bir diğeri de temel durum yörüngesinin açısal momentumu için yanlış bir değer sağlamasıdır. Bahsedilen tüm bu hatalar ve sınırlamalar Bohr'un atom modelinin yerini yıllar sonra kuantum teorisine bıraktı.
Umarım bu makale ile Bohr'un atom modeli ve bilimdeki uygulamaları hakkında daha fazla bilgi edinebilirsiniz.