
Tiyak na nakita mo na ang Bohr atomic model. Ito ay lubos na isang mahalagang pagtuklas na ginawa ng siyentipikong ito para sa agham, lalo na ang electromagnetism at electrochemistry. Dati mayroong modelo ng Rutherford, na kung saan ay medyo rebolusyonaryo at matagumpay, ngunit may ilang mga salungatan sa iba pang mga batas sa atomik tulad ng Maxwell at Newton's.
Sa artikulong ito sasabihin namin sa iyo ang lahat ng kailangan mong malaman tungkol sa modelo ng atomic ni Bohr, pati na rin ang mga detalye nito upang linawin ang anumang mga pagdududa sa paksa.
Mga problemang nakatulong ito sa paglutas
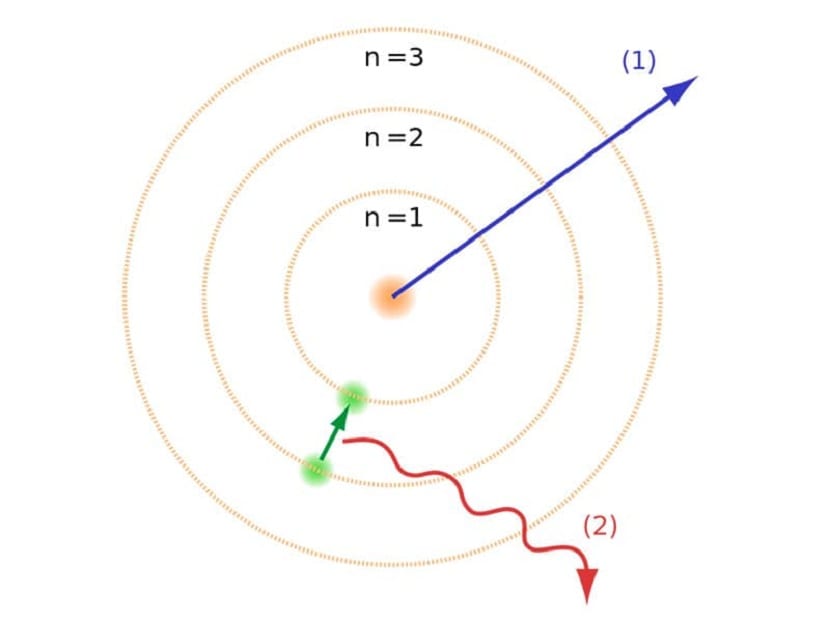
Tulad ng nabanggit namin sa simula ng artikulo, ang modelo ng atomic na ito ay nakatulong sa paglutas ng ilang mga salungatan na mayroon sa ibang mga batas sa atomic. Sa nakaraang modelo ng Rutherford, kailangan namin Ang mga electron na gumagalaw na may negatibong singil sa elektrisidad ay kailangang maglabas ng isang uri ng electromagnetic radiation. Dapat itong matupad dahil sa mga batas ng electromagnetism doon. Ang pagkawala ng enerhiya na ito ay sanhi ng mga electron na nabawasan sa kanilang orbit sa pamamagitan ng pag-spiral patungo sa gitna. Nang makarating sila sa gitna ay gumuho sila, bumangga sa core.
Nilikha ito ng isang problema sa teorya dahil hindi ito maaaring gumuho sa nucleus ng mga atomo, ngunit ang pinag-uusapan ng mga electron ay dapat na naiiba. Nalutas ito sa modelo ng atomic na Bohr. Ipinapaliwanag nito na ang mga electron ay umiikot sa paligid ng nucleus sa ilang mga orbit na pinapayagan at mayroong isang tiyak na enerhiya. Ang enerhiya ay proporsyonal sa pare-pareho ng Planck.
Ang mga orbit na ito na nabanggit natin kung saan gumagalaw ang mga electron, ay tinawag na layer ng enerhiya o antas ng enerhiya. Iyon ay, ang enerhiya na taglay ng mga electron ay hindi pareho palagi, ngunit nasukat. Ang mga antas ng kabuuan ay ang iba't ibang mga orbit kung saan matatagpuan ang mga atomo. Nakasalalay sa kung aling orbit ito nasa anumang naibigay na sandali, magkakaroon ito ng higit o mas kaunting enerhiya. Ang mga orbit na mas malapit sa nucleus ng atom ay may mas malaking dami ng enerhiya. Sa kabilang banda, mas malayo sa nucleus ang mas kaunting enerhiya.
Modelong antas ng enerhiya
Ang modelo ng atom na Bohr na ito, na nagpapahiwatig na ang mga electron ay makakakuha lamang o mawawalan ng enerhiya sa pamamagitan ng paglukso mula sa isang orbita patungo sa isa pa, na tumulong upang malutas ang pagbagsak na iminungkahi ng modelo ni Rutherford. Kapag lumilipat mula sa isang antas ng enerhiya patungo sa isa pa, sumisipsip o nagpapalabas ng electromagnetic radiation. Iyon ay, kapag tumalon ka mula sa isang mas sisingilin na antas ng enerhiya sa isang hindi gaanong sisingilin, pinakawalan mo ang labis na enerhiya. Sa kabaligtaran, kapag pumupunta ito mula sa isang mababang antas ng enerhiya hanggang sa mas mataas, sumisipsip ito ng electromagnetic radiation.
Tulad ng modelong atomic na ito ay isang pagbabago ng modelo ng Rutherford, ang mga katangian ng maliit na gitnang nukleus at kasama ang karamihan ng masa ng atomo ay pinapanatili. Bagaman ang mga orbit ng mga electron ay hindi patag tulad ng mga planeta, masasabing ang mga electron na ito ay umiikot sa kanilang nucleus sa katulad na paraan sa mga planeta sa paligid ng Araw.
Mga prinsipyo ng modelo ng atomic ng Bohr

Susuriin namin ngayon ang mga prinsipyo ng modelong atomic na ito. Ito ay tungkol sa isang detalyadong paliwanag ng nasabing modelo at ang pagpapatakbo nito.
- Ang mga particle na may positibong singil Ang mga ito ay nasa mababang konsentrasyon kumpara sa kabuuang dami ng atom.
- Ang mga electron na may negatibong singil sa elektrisidad ay ang mga matatagpuan na umiikot sa paligid ng nucleus sa pabilog na mga orbit ng enerhiya.
- Mayroong mga antas ng enerhiya ng mga orbit kung saan nagpapalipat-lipat ang mga electron. Mayroon din silang isang itinakdang laki, kaya't walang katayuang estado sa pagitan ng mga orbit. Pumunta lamang sila mula sa isang antas patungo sa isa pa.
- Ang lakas na taglay ng bawat orbit ay nauugnay sa laki nito. Ang karagdagang orbit ay mula sa nucleus ng atom, mas maraming enerhiya na mayroon ito.
- Ang mga antas ng enerhiya ay may iba't ibang bilang ng mga electron. Mas mababa ang antas ng enerhiya, mas kaunti ang mga electron na naglalaman nito. Halimbawa, kung nasa antas isa tayo, magkakaroon ng hanggang sa dalawang electron. Sa antas 2, maaaring mayroong hanggang 8 electron, iba pa.
- Kapag ang mga electron ay lumilipat mula sa isang orbita papunta sa isa pa, sumisipsip o naglalabas sila ng electromagnetic na enerhiya. Kung pupunta ka mula sa isa pang masiglang antas patungo sa isa pang mas mababa, naglalabas ka ng labis na enerhiya at kabaliktaran.
Ang modelong ito ay rebolusyonaryo at sinubukan na magbigay ng isang katatagan sa materyal na wala sa mga nakaraang modelo. Ang discrete emission at pagsipsip na specra ng mga gas ay ipinaliwanag din sa modelong atomic na ito. Ito ang unang modelo na nagpakilala sa konsepto ng dami o dami. Ginagawa nitong maituring na isang modelo ang atomic model ni Bohr na nasa pagitan ng mga klasikong mekanika at mekanika ng kabuuan. Bagaman mayroon din itong mga pagkukulang, ito ay isang modelo ng pauna para sa mga susunod na mekanika ng kabuuan ng Schrödinger at iba pang mga siyentipiko.
Mga limitasyon at pagkakamali ng modelo ng atom na Bohr
Tulad ng nabanggit namin, ang modelong ito ay mayroon ding ilang mga pagkukulang at pagkakamali. Una sa lahat, hindi ito nagpapaliwanag o nagbibigay ng mga kadahilanan kung bakit ang mga electron ay kailangang limitado lamang sa mga tiyak na orbit. Direktang ipinapalagay na ang mga electron ay may kilalang radius at orbit. Gayunpaman, hindi ito ganon. Makalipas ang isang dekada Ang prinsipyo ng kawalang katiyakan ni Heisenberg ay hindi pinatunayan ito.
Bagaman ang modelo ng atomic na ito ay nakapagmomodelo ng pag-uugali ng mga electron sa mga hydrogen atoms, hindi ito ganoong eksakto pagdating sa mga elemento na may mas mataas na bilang ng mga electron. Ito ay isang modelo na ay may problema sa pagpapaliwanag ng Zeeman epekto. Ang epektong ito ay ang makikita kapag ang mga linya ng parang multo ay nahahati sa dalawa o higit pa sa pagkakaroon ng isang panlabas at static na magnetic field.
Ang isa pa sa mga pagkakamali at limitasyon na mayroon ang modelong ito ay nagbibigay ito ng isang maling halaga para sa angular momentum ng orbit ng estado ng lupa. Ang lahat ng mga pagkakamali at limitasyong ito ay nabanggit na sanhi na ang modelo ng atomic ng Bohr ay pinalitan ng teorya ng kabuuan taon na ang lumipas.
Inaasahan ko na sa artikulong ito maaari kang matuto nang higit pa tungkol sa modelo ng atomic ng Bohr at mga aplikasyon nito sa agham.