ในโลกของฟิสิกส์มีสาขาหนึ่งที่รับผิดชอบในการศึกษาการเปลี่ยนแปลงที่เกิดจากความร้อนและทำงานในระบบ มันเกี่ยวกับ อุณหพลศาสตร์ เป็นสาขาหนึ่งของฟิสิกส์ที่รับผิดชอบในการศึกษาการเปลี่ยนแปลงทั้งหมดที่เป็นผลมาจากกระบวนการที่เกี่ยวข้องกับการเปลี่ยนแปลงของตัวแปรสถานะทั้งอุณหภูมิและพลังงานในระดับมหภาค
ในบทความนี้เราจะบอกทุกสิ่งที่คุณจำเป็นต้องรู้เกี่ยวกับอุณหพลศาสตร์และหลักการของอุณหพลศาสตร์
คุณสมบัติหลัก
ถ้าเราทำการวิเคราะห์อุณหพลศาสตร์คลาสสิกเราจะเห็นว่ามันเป็นไปตามแนวคิดของระบบมหภาค ระบบนี้ไม่ได้เป็นอะไรมากไปกว่าส่วนของมวลทางกายภาพหรือเชิงความคิดที่แยกออกจากสภาพแวดล้อมภายนอก เพื่อที่จะศึกษาระบบอุณหพลศาสตร์ได้ดีขึ้นมักจะถือว่าเป็นมวลทางกายภาพที่ไม่ถูกรบกวนจากการแลกเปลี่ยนพลังงานกับระบบนิเวศภายนอก
สถานะของระบบมหภาคคืออะไร ในสภาวะสมดุลจะถูกระบุโดยปริมาณที่เรียกว่าตัวแปรอุณหพลศาสตร์ เรารู้จักตัวแปรทั้งหมดนี้ ได้แก่ อุณหภูมิความดันปริมาตรและองค์ประกอบทางเคมี ตัวแปรทั้งหมดนี้คือสิ่งที่กำหนดระบบและดุลยภาพของมัน สัญกรณ์หลักที่มีในอุณหพลศาสตร์เคมีได้รับการกำหนดขึ้นโดยใช้สหภาพสากล ด้วยหน่วยเหล่านี้กฎของอุณหพลศาสตร์สามารถทำงานและอธิบายได้ดีขึ้น
อย่างไรก็ตามมีสาขาหนึ่งของอุณหพลศาสตร์ที่ไม่ได้ศึกษาเรื่องดุลยภาพ แต่มีหน้าที่ในการวิเคราะห์กระบวนการทางอุณหพลศาสตร์ที่มีลักษณะเฉพาะเป็นหลัก ไม่มีความสามารถในการบรรลุสภาวะสมดุลในทางที่มั่นคง
กฎหมาย
หลักการดังกล่าวถูกประณามในช่วงศตวรรษที่ XNUMX ซึ่งเป็นผู้ที่ พวกเขามีหน้าที่ควบคุมการเปลี่ยนแปลงทั้งหมดและความก้าวหน้าของพวกเขา พวกเขายังวิเคราะห์ว่าขอบเขตที่แท้จริงคืออะไรเพื่อให้มีความคิดที่แท้จริง เป็นสัจพจน์ที่พิสูจน์ไม่ได้ แต่พิสูจน์ไม่ได้จากประสบการณ์ ทุกทฤษฎีของอุณหพลศาสตร์ตั้งอยู่บนหลักการเหล่านี้ เราสามารถแยกแยะหลักการพื้นฐาน 3 ข้อบวกกับหลักการ แต่นั่นคือหลักการที่กำหนดอุณหภูมิและมีนัยในอีก 3 หลักการ
กฎหมายเป็นศูนย์
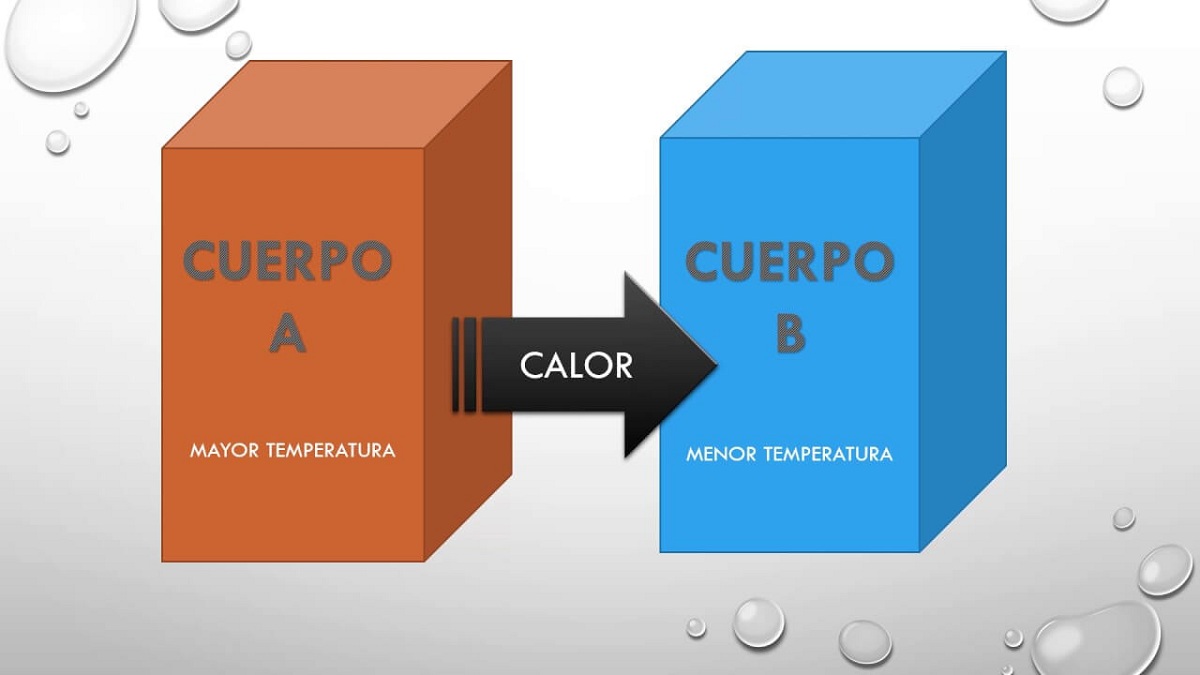
เรากำลังจะอธิบายว่ากฎศูนย์นี้คืออะไรซึ่งเป็นข้อแรกที่อธิบายอุณหภูมิที่มีนัยในหลักการที่เหลือ เมื่อสองระบบมีปฏิสัมพันธ์กันและอยู่ในสภาวะสมดุลทางความร้อนพวกเขาจะแบ่งปันคุณสมบัติบางอย่าง คุณสมบัติเหล่านี้ที่แบ่งปันซึ่งกันและกันสามารถวัดได้และกำหนดค่าเป็นตัวเลข ด้วยเหตุนี้หากทั้งสองระบบอยู่ในภาวะสมดุลกับหนึ่งในสามระบบจะอยู่ในสภาวะสมดุลซึ่งกันและกันและคุณสมบัติที่ใช้ร่วมกันคืออุณหภูมิ
ดังนั้นหลักการนี้ แต่เพียงระบุว่าถ้า ร่างกาย A อยู่ในสภาวะสมดุลกับร่างกาย B และร่างกายนี้ B จะอยู่ในสภาวะสมดุลทางความร้อนกับร่างกาย C จากนั้นร่างกาย A และ C ก็จะอยู่ในภาวะสมดุล ความร้อน. หลักการนี้อธิบายถึงความจริงที่ว่าร่างกายทั้งสองที่อุณหภูมิต่างกันสามารถแลกเปลี่ยนความร้อนซึ่งกันและกันได้ ไม่ช้าก็เร็วร่างกายทั้งสองจะถึงอุณหภูมิเดียวกันดังนั้นพวกเขาจึงอยู่ในสภาวะสมดุลทั้งหมด
กฎข้อแรกของอุณหพลศาสตร์
เมื่อร่างกายสัมผัสกับร่างกายที่เย็นกว่าการเปลี่ยนแปลงจะเกิดขึ้นซึ่งนำไปสู่สภาวะสมดุล สภาวะสมดุลนี้ขึ้นอยู่กับข้อเท็จจริงที่ว่าอุณหภูมิของร่างกายทั้งสองเท่ากันเนื่องจากการถ่ายเทพลังงานจะเพิ่มขึ้นระหว่างร่างกายที่ร้อนสำหรับร่างกายที่เย็น เพื่ออธิบายปรากฏการณ์นี้นักวิทยาศาสตร์สันนิษฐานว่าสารร้อนที่มีอยู่ในปริมาณที่มากขึ้นผ่านร่างกายที่เย็นกว่า มันเป็นความคิดของของเหลวที่สามารถเคลื่อนที่ผ่านมวลเพื่อแลกเปลี่ยนความร้อนได้
หลักการนี้มีหน้าที่ในการระบุความร้อนเป็นพลังงานรูปแบบหนึ่ง ไม่ใช่สารสำคัญ ด้วยวิธีนี้อาจแสดงได้ว่าความร้อนซึ่งวัดเป็นแคลอรี่และงานที่วัดเป็นจูลนั้นเทียบเท่ากัน ดังนั้นวันนี้เรารู้ดีว่า 1 แคลอรี่อยู่ที่ประมาณ 4,186 จูล
กล่าวได้ว่าหลักการแรกของอุณหพลศาสตร์เป็นหลักการอนุรักษ์พลังงาน พลังงานจำนวนหนึ่งในเครื่องยนต์ความร้อนจะถูกแปลงเป็นงานและสามารถมองเห็นได้จากเครื่องจักรใด ๆ ที่สามารถผลิตงานดังกล่าวได้โดยไม่ต้องใช้พลังงาน เราสามารถสร้างหลักการแรกนี้ได้ว่า: การแปรผันของพลังงานภายในของระบบอุณหพลศาสตร์แบบปิดจะเท่ากับความแตกต่างที่มีอยู่ระหว่างความร้อนที่จ่ายให้กับระบบและงานที่ทำโดยระบบดังกล่าวในสิ่งแวดล้อม
กฎข้อที่สองของอุณหพลศาสตร์
สิ่งนี้ในตอนแรกระบุว่าเป็นไปไม่ได้ที่จะสร้างเครื่องจักรที่เป็นวัฏจักรซึ่งส่งผลให้เกิดการถ่ายเทความร้อนจากร่างกายที่เย็นไปยังร่างกายที่อบอุ่นเท่านั้น เราสามารถพูดได้ว่าเป็นไปไม่ได้ที่การเปลี่ยนแปลงจะดำเนินไปได้ซึ่งผลลัพธ์จะเป็นเท่านั้น นั่นคือการแปลงความร้อนที่เราสกัดจากแหล่งเดียวให้เป็นงานเชิงกล
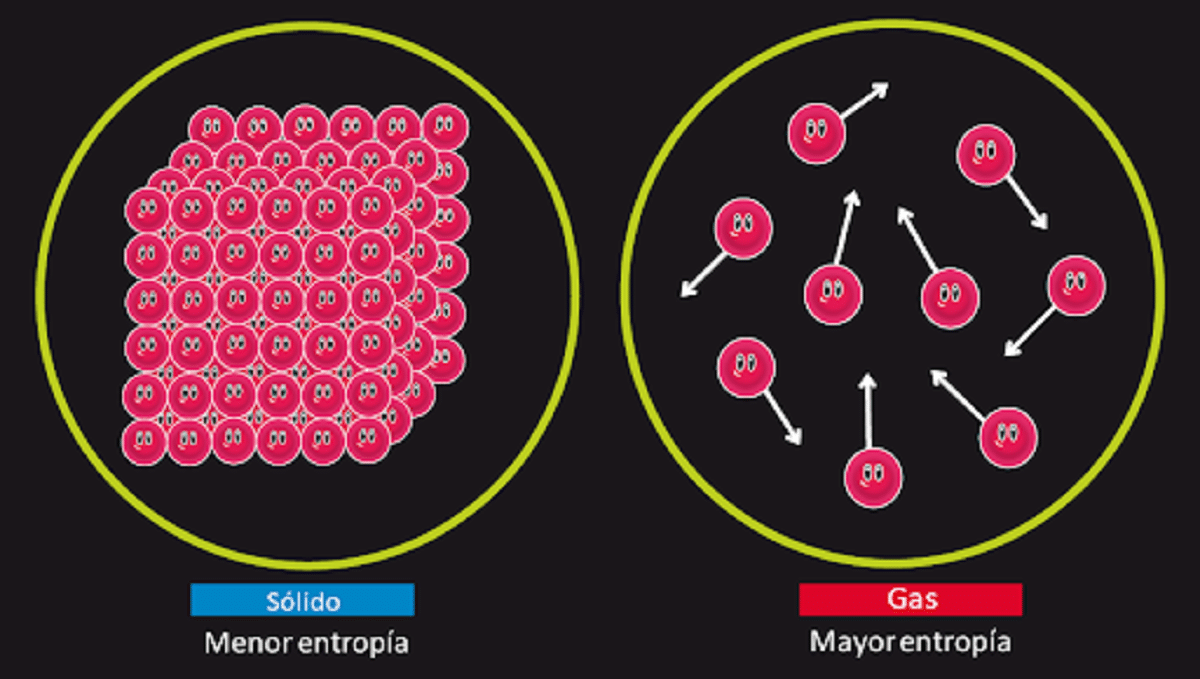
หลักการนี้รับผิดชอบในการปฏิเสธความเป็นไปได้ที่การเคลื่อนที่ตลอดไปของสิ่งมีชีวิตชนิดที่สองนั้นมีอยู่จริง เรารู้ว่า เอนโทรปี ของระบบยังคงแยกไม่เปลี่ยนแปลงเมื่อเกิดการเปลี่ยนแปลงแบบย้อนกลับ เรารู้ด้วยว่ามันจะเพิ่มขึ้นเมื่อเกิดการเปลี่ยนแปลงที่ไม่สามารถย้อนกลับได้
กฎข้อที่สามของอุณหพลศาสตร์
หลักการสุดท้ายนี้เกี่ยวข้องอย่างใกล้ชิดกับข้อที่สองและถือเป็นผลของมัน หลักการนี้ยืนยันว่าสิ่งมีชีวิตสัมบูรณ์ไม่สามารถเกิดเป็นสีได้ด้วยการเปลี่ยนแปลงจำนวน จำกัด เรารู้ว่ามีศูนย์สัมบูรณ์ไม่เกินอุณหภูมิต่ำสุดที่สามารถเข้าถึงได้ ในหน่วย เคลวินเรารู้ว่ามันเป็น 0 แต่ในองศาเซลเซียสมีค่า -273.15 องศา
นอกจากนี้ยังระบุด้วยว่าเอนโทรปีของของแข็งที่เป็นผลึกสมบูรณ์โดยมีอุณหภูมิ 0 เคลวินเท่ากับ 0 ซึ่งหมายความว่าจะไม่มีเอนโทรปีดังนั้นระบบจะมีเสถียรภาพโดยสิ้นเชิง พลังงานของการปลดปล่อยการแปลและการหมุนของอนุภาคที่ประกอบกันจะไม่มีค่าอะไรเลยที่อุณหภูมิ 0 เคลวิน
ฉันหวังว่าข้อมูลนี้จะทำให้คุณสามารถเรียนรู้เพิ่มเติมเกี่ยวกับอุณหพลศาสตร์และหลักการพื้นฐานได้