
La เลย์ เดอ บอยล์ มันถูกค้นพบโดย Robert Boyle ในศตวรรษที่ XNUMX และวางรากฐานเพื่ออธิบายความสัมพันธ์ระหว่างความดันและปริมาตรที่มีอยู่ในก๊าซ จากการทดลองหลายครั้ง เขาสามารถแสดงให้เห็นว่าถ้าอุณหภูมิคงที่ ก๊าซจะลดปริมาตรของมันเมื่ออยู่ภายใต้แรงกดดันที่มากขึ้น และเพิ่มปริมาตรหากความดันลดลง
ในบทความนี้เราจะบอกคุณทุกสิ่งที่คุณจำเป็นต้องรู้เกี่ยวกับกฎของบอยล์ ลักษณะและความสำคัญของกฎ
คุณสมบัติหลัก
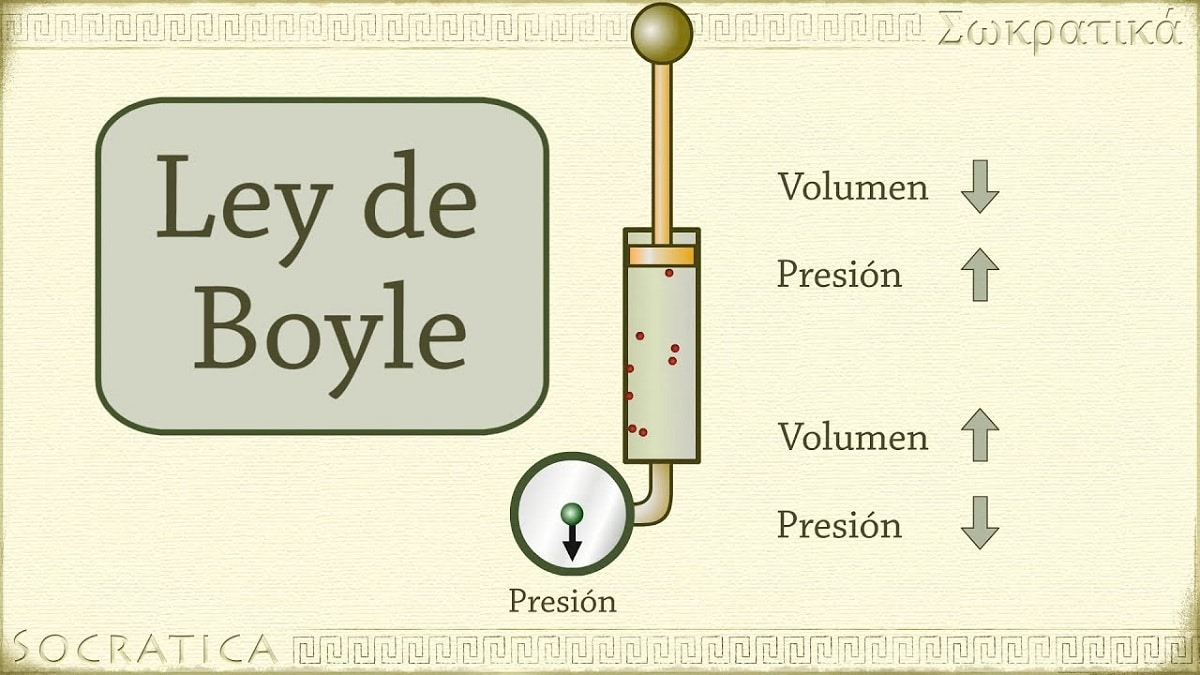
ในปี ค.ศ. 1662 โรเบิร์ต บอยล์ ค้นพบว่าความดันที่กระทำต่อแก๊สนั้นแปรผกผันกับปริมาตรและจำนวนโมลที่อุณหภูมิคงที่ กล่าวอีกนัยหนึ่งถ้าความดันที่ใช้กับแก๊สเพิ่มขึ้นเป็นสองเท่า ก๊าซชนิดเดียวกันจะถูกบีบอัดและปริมาตรจะลดลงครึ่งหนึ่ง
เมื่อปริมาตรของภาชนะที่บรรจุก๊าซเพิ่มขึ้น ระยะห่างที่อนุภาคต้องเดินทางก่อนที่จะชนกับผนังของภาชนะก็จะเพิ่มขึ้นเช่นกัน ระยะห่างที่เพิ่มขึ้นนี้ทำให้ความถี่ของแรงกระแทกลดลง ดังนั้นแรงกดที่ผนังจะน้อยกว่าเมื่อก่อนเมื่อปริมาตรมีขนาดเล็กลง
กฎของบอยล์ถูกค้นพบครั้งแรกในปี ค.ศ. 1662 โดยโรเบิร์ต บอยล์ Edme Mariotte เป็นนักวิทยาศาสตร์อีกคนที่คิดและได้ข้อสรุปเช่นเดียวกับ Boyleอย่างไรก็ตาม Mariotte ไม่ได้เผยแพร่ผลงานของเขาต่อสาธารณะจนถึงปี 1676 นั่นคือเหตุผลที่ในหนังสือหลายเล่มเราพบว่ากฎหมายนี้เรียกว่า Boyle and Mariot's Law Boyle-Mariot's Law หรือที่เรียกว่า Mattut's Law ซึ่งพัฒนาโดยนักฟิสิกส์และนักเคมีชาวอังกฤษ Robert It ได้ถูกคิดค้นขึ้น โดยอิสระโดย Boyle และนักฟิสิกส์และนักพฤกษศาสตร์ชาวฝรั่งเศส Edmé Mattout
หมายถึงกฎข้อใดข้อหนึ่งที่เกี่ยวข้องกับปริมาตรและความดันของก๊าซกับก๊าซจำนวนหนึ่งที่รักษาอุณหภูมิคงที่ กฎของบอยล์กล่าวไว้ดังนี้: ความดันที่กระทำโดยแรงแปรผกผันกับปริมาตรของสสารก๊าซตราบเท่าที่อุณหภูมิของมันคงที่ หรือง่ายกว่านั้น เราสามารถตีความได้ว่า: ที่อุณหภูมิคงที่ที่สูงขึ้น ปริมาตรของมวลคงที่ของก๊าซจะแปรผกผันกับความดันคงที่ที่มันกระทำ
การทดลองและการประยุกต์ใช้กฎของบอยล์

เพื่อพิสูจน์ทฤษฎีกฎของบอยล์ มาริออตมีหน้าที่แนะนำแก๊สเข้าไปในกระบอกสูบที่มีลูกสูบ และสามารถตรวจสอบแรงดันต่างๆ ที่ก่อตัวขึ้นเมื่อลูกสูบเคลื่อนลงมา จากการทดลองนี้อนุมานได้ว่าเมื่อปริมาตรเพิ่มขึ้น ความดันจะลดลง
กฎของบอยล์มีประโยชน์หลายอย่างในชีวิตสมัยใหม่ ซึ่งเราสามารถพูดถึงตัวอย่างเช่น การดำน้ำ เนื่องจากนักประดาน้ำต้องขับลมออกจากปอดเมื่อขึ้นไปเพราะมันจะขยายตัวเมื่อความดันลดลง หากไม่ทำเช่นนั้น อาจทำให้เนื้อเยื่อเสียหายได้
พบได้ในอุปกรณ์ทั้งหมดที่ใช้หรือขับเคลื่อนด้วยพลังงานลม เช่น แขนหุ่นยนต์ที่ใช้ส่วนประกอบ เช่น ลูกสูบนิวเมติก แอคทูเอเตอร์ ตัวควบคุมแรงดัน และวาล์วระบายแรงดัน
เครื่องยนต์เบนซิน แก๊ส หรือดีเซลยังใช้กฎของบอยล์ในระหว่างการเผาไหม้ภายใน เพราะในครั้งแรกที่อากาศเข้าสู่กระบอกสูบด้วยปริมาตรและแรงดัน ครั้งที่สองจะลดปริมาตรโดยการเพิ่มแรงดัน
รถยนต์มีระบบถุงลมนิรภัยที่ทำงานโดยการไล่อากาศหรือก๊าซจำนวนหนึ่งออกจากห้องที่ไปถึงถุงลมนิรภัยด้านนอก โดยที่ความดันลดลงและปริมาตรเพิ่มขึ้นโดยรักษาอุณหภูมิให้คงที่
กฎของบอยล์มีความสำคัญมากในปัจจุบันเพราะเป็นกฎที่พูดกับเราและอธิบายพฤติกรรมของก๊าซ มันอธิบายได้อย่างชัดเจนว่าความดันและปริมาตรของก๊าซเป็นสัดส่วนผกผันซึ่งกันและกัน ดังนั้น เมื่อใช้แรงดันกับแก๊ส ปริมาตรของแก๊สจะลดลงและแรงดันจะเพิ่มขึ้น
แบบจำลองก๊าซในอุดมคติ

กฎหมาย Boyle-Mariotte ใช้กับสิ่งที่เรียกว่าก๊าซในอุดมคติ ซึ่งเป็นแบบจำลองทางทฤษฎีที่ทำให้พฤติกรรมของก๊าซต่างๆ ง่ายขึ้นอย่างมาก โดยสมมติว่า:
- โมเลกุลของแก๊ส มันเล็กมากจนไม่จำเป็นต้องนึกถึงขนาดของมันโดยเฉพาะอย่างยิ่งเมื่อพิจารณาว่าระยะทางนี้น้อยกว่าระยะทางที่พวกเขาเดินทางมาก
- นอกจากนี้ โมเลกุลแทบไม่มีปฏิสัมพันธ์ยกเว้นเมื่อชนกันชั่วครู่ และเมื่อชนกัน การชนนั้นยืดหยุ่น ดังนั้นทั้งโมเมนตัมและพลังงานจลน์จะถูกอนุรักษ์ไว้
- สุดท้าย สมมติว่าพลังงานจลน์นี้เป็นสัดส่วนกับอุณหภูมิของตัวอย่างก๊าซ นั่นคือ ยิ่งอนุภาคกระวนกระวายมาก อุณหภูมิก็จะยิ่งสูงขึ้น
ปฏิบัติตามแนวทางเหล่านี้อย่างเคร่งครัดภายใต้สภาวะมาตรฐานของอุณหภูมิและความดัน (เช่น 0ºC และความดันบรรยากาศ (1 ชั้นบรรยากาศ) โดยไม่คำนึงถึงเอกลักษณ์ของก๊าซเหล่านี้ สำหรับก๊าซเหล่านี้ กฎหมาย Boyle-Mariotte อธิบายพฤติกรรมของพวกมันอย่างแม่นยำมาก
เนื่องจาก P∙V เป็นค่าคงที่ที่อุณหภูมิที่กำหนด หากความดันของก๊าซเปลี่ยนแปลง ปริมาตรจะเปลี่ยนไปเพื่อให้ผลิตภัณฑ์ยังคงเหมือนเดิม ดังนั้นในสถานะที่แตกต่างกัน 1 สถานะ 2 และ XNUMX ความเท่าเทียมกันสามารถแสดงความเท่าเทียมกันได้ดังนี้
P1∙V1 = P2∙V2
จากนั้นเมื่อทราบสถานะหนึ่ง บวกกับตัวแปรจากอีกสถานะหนึ่ง คุณจะทราบตัวแปรที่ขาดหายไปได้โดยการลบออกจากกฎหมาย Boyle-Mariot
ประวัติกฎของบอยล์
นักเคมีชาวอังกฤษ ผู้บุกเบิกการทดลองด้านเคมีโดยเฉพาะคุณสมบัติของก๊าซ
วิทยานิพนธ์ของ Robert Boyle เกี่ยวกับพฤติกรรมของสสารที่ระดับอนุภาคเป็นจุดเริ่มต้นของทฤษฎีสมัยใหม่ขององค์ประกอบทางเคมี เขายังเป็นสมาชิกผู้ก่อตั้งของ Royal Society of London
Robert Boyle เกิดในตระกูลขุนนางในไอร์แลนด์และเข้าเรียนในโรงเรียนสอนภาษาอังกฤษและยุโรปที่ดีที่สุด ตั้งแต่ปี ค.ศ. 1656 ถึงปี ค.ศ. 1668 เขาทำหน้าที่เป็นผู้ช่วยของโรเบิร์ต ฮุกที่มหาวิทยาลัยอ็อกซ์ฟอร์ด โดยร่วมมือกับเขาในการทดลองต่างๆ ที่กำหนดคุณสมบัติทางกายภาพของอากาศและวิธีที่อากาศเผาไหม้ หายใจ และส่งเสียง
ผลลัพธ์ของการบริจาคเหล่านี้ถูกรวบรวมไว้ใน «การทดลองทางกายภาพและทางกลใหม่เกี่ยวกับความยืดหยุ่นของอากาศและผลกระทบของมัน» (1660). ในฉบับที่สองของงานนี้ (1662) เขาได้เปิดเผยคุณสมบัติที่มีชื่อเสียงของก๊าซ กฎหมาย Boyle-Mariotte ซึ่งระบุว่าปริมาตรที่ก๊าซครอบครองที่อุณหภูมิคงที่นั้นแปรผกผันกับความดันของมัน วันนี้เป็นที่ทราบกันดีอยู่แล้วว่ากฎหมายนี้จะเป็นจริงก็ต่อเมื่อยอมรับพฤติกรรมในอุดมคติทางทฤษฎีของก๊าซ
ฉันหวังว่าด้วยข้อมูลนี้ คุณจะได้เรียนรู้เพิ่มเติมเกี่ยวกับกฎของบอยล์ คุณลักษณะ และการประยุกต์ใช้ในโลกแห่งวิทยาศาสตร์