
நீங்கள் எப்போதாவது பார்த்தீர்களா போர் அணு மாதிரி. இந்த விஞ்ஞானி அறிவியலுக்காக, குறிப்பாக மின்காந்தவியல் மற்றும் மின் வேதியியலுக்காக செய்த மிக முக்கியமான கண்டுபிடிப்பு இது. முன்னதாக ரதர்ஃபோர்ட் மாதிரி இருந்தது, இது மிகவும் புரட்சிகரமானது மற்றும் மிகவும் வெற்றிகரமாக இருந்தது, ஆனால் மேக்ஸ்வெல் மற்றும் நியூட்டன் போன்ற பிற அணு சட்டங்களுடன் சில மோதல்கள் இருந்தன.
இந்த கட்டுரையில், போரின் அணு மாதிரியைப் பற்றி நீங்கள் தெரிந்து கொள்ள வேண்டிய அனைத்தையும், இந்த விஷயத்தில் ஏதேனும் சந்தேகங்களை தெளிவுபடுத்துவதற்கான விவரங்களையும் நாங்கள் உங்களுக்கு சொல்லப்போகிறோம்.
இது தீர்க்க உதவிய சிக்கல்கள்
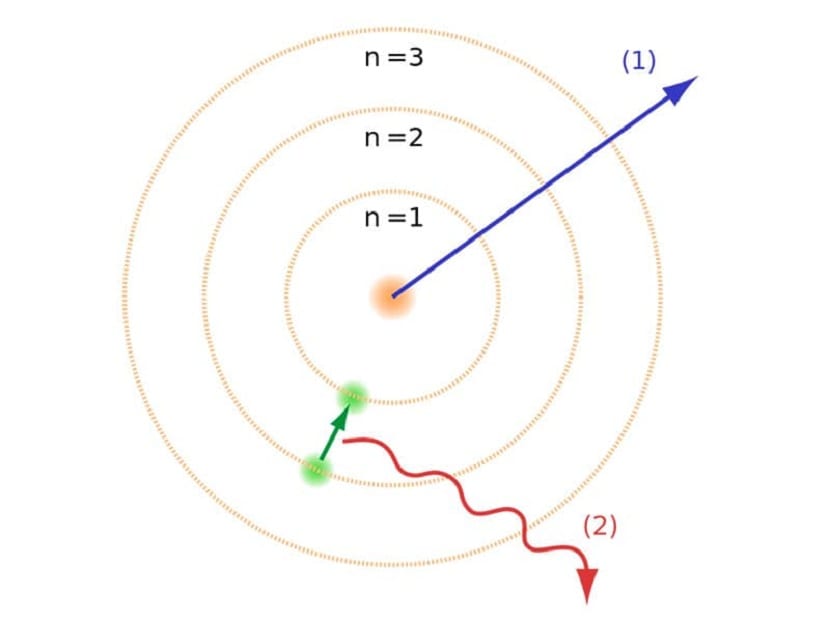
கட்டுரையின் ஆரம்பத்தில் நாம் குறிப்பிட்டது போல, இந்த அணு மாதிரி மற்ற அணு சட்டங்களுடன் இருந்த சில மோதல்களை தீர்க்க உதவியது. முந்தைய ரதர்ஃபோர்ட் மாதிரியில், நாங்கள் செய்ய வேண்டியிருந்தது எதிர்மறை மின் கட்டணத்துடன் நகரும் எலக்ட்ரான்கள் ஒரு வகை மின்காந்த கதிர்வீச்சை வெளியிட வேண்டியிருந்தது. அங்குள்ள மின்காந்தவியல் சட்டங்கள் காரணமாக இது நிறைவேற்றப்பட வேண்டும். இந்த ஆற்றல் இழப்பு எலக்ட்ரான்களை மையத்தை நோக்கி சுழல்வதன் மூலம் அவற்றின் சுற்றுப்பாதையில் குறைக்கப்படுகிறது. அவை மையத்தை அடைந்தபோது அவை சரிந்து விழுந்தன.
இது அணுக்களின் கருவுடன் சரிந்துவிட முடியாது என்பதால் இது கோட்பாட்டில் ஒரு சிக்கலை உருவாக்கியது, ஆனால் எலக்ட்ரான்களின் பாதை வேறுபட்டிருக்க வேண்டும். இது போர் அணு மாதிரியுடன் தீர்க்கப்பட்டது. அது விளக்குகிறது எலக்ட்ரான்கள் அனுமதிக்கப்பட்ட மற்றும் ஒரு குறிப்பிட்ட ஆற்றலைக் கொண்ட சில சுற்றுப்பாதையில் கருவைச் சுற்றி வருகின்றன. ஆற்றல் பிளாங்கின் மாறிலிக்கு விகிதாசாரமாகும்.
எலக்ட்ரான்கள் எங்கு நகர்கின்றன என்பதை நாம் குறிப்பிட்டுள்ள இந்த சுற்றுப்பாதைகள் ஆற்றல் அடுக்குகள் அல்லது ஆற்றல் நிலைகள் என்று அழைக்கப்பட்டன. அதாவது, எலக்ட்ரான்களுக்கு இருக்கும் ஆற்றல் எப்போதும் ஒரே மாதிரியாக இருக்காது, ஆனால் அளவிடப்படுகிறது. குவாண்டம் அளவுகள் அணுக்கள் காணப்படும் வெவ்வேறு சுற்றுப்பாதைகள். எந்த நேரத்திலும் அது எந்த சுற்றுப்பாதையில் உள்ளது என்பதைப் பொறுத்து, அதற்கு அதிகமாகவோ அல்லது குறைவாகவோ ஆற்றல் இருக்கும். அணுவின் கருவுக்கு நெருக்கமான சுற்றுப்பாதைகள் அதிக அளவு ஆற்றலைக் கொண்டுள்ளன. மறுபுறம், அவை கருவிலிருந்து எவ்வளவு தூரம் நகர்கின்றனவோ, குறைந்த ஆற்றல்.
ஆற்றல் நிலை மாதிரி
எலக்ட்ரான்கள் ஒரு சுற்றுப்பாதையில் இருந்து இன்னொரு சுற்றுக்குச் செல்வதன் மூலம் மட்டுமே ஆற்றலைப் பெறவோ அல்லது இழக்கவோ முடியும் என்பதைக் குறிக்கும் இந்த போர் அணு மாதிரி, ரதர்ஃபோர்டின் மாதிரியால் முன்மொழியப்பட்ட சரிவைத் தீர்க்க உதவியது. ஒரு ஆற்றல் மட்டத்திலிருந்து இன்னொரு நிலைக்கு நகரும்போது, அது மின்காந்த கதிர்வீச்சை உறிஞ்சி அல்லது வெளியேற்றும். அதாவது, நீங்கள் அதிக கட்டணம் வசூலிக்கப்பட்ட ஆற்றல் மட்டத்திலிருந்து குறைந்த கட்டணம் வசூலிக்கும்போது, அதிகப்படியான ஆற்றலை வெளியிடுகிறீர்கள். மாறாக, இது குறைந்த ஆற்றல் மட்டத்திலிருந்து உயர்ந்த நிலைக்குச் செல்லும்போது, அது மின்காந்த கதிர்வீச்சை உறிஞ்சிவிடும்.
இந்த அணு மாதிரி ரதர்ஃபோர்டு மாதிரியின் மாற்றமாக இருப்பதால், சிறிய மையக் கருவின் பண்புகள் மற்றும் அணுவின் பெரும்பகுதியுடன் பராமரிக்கப்படுகிறது. எலக்ட்ரான்களின் சுற்றுப்பாதைகள் கிரகங்களைப் போல தட்டையானவை அல்ல என்றாலும், இந்த எலக்ட்ரான்கள் சூரியனைச் சுற்றியுள்ள கிரகங்களுக்கு ஒத்த வழியில் அவற்றின் கருவைச் சுற்றி சுழல்கின்றன என்று கூறலாம்.
போரின் அணு மாதிரி கொள்கைகள்

இந்த அணு மாதிரியின் கொள்கைகளை நாம் இப்போது பகுப்பாய்வு செய்யப் போகிறோம். இது கூறப்பட்ட மாதிரி மற்றும் அதன் செயல்பாட்டின் விரிவான விளக்கத்தைப் பற்றியது.
- நேர்மறை கட்டணம் கொண்ட துகள்கள் அணுவின் மொத்த அளவோடு ஒப்பிடும்போது அவை குறைந்த செறிவில் உள்ளன.
- எதிர்மறை மின் கட்டணம் கொண்ட எலக்ட்ரான்கள் ஆற்றலின் வட்ட சுற்றுப்பாதையில் கருவைச் சுற்றிக் காணப்படுகின்றன.
- எலக்ட்ரான்கள் சுற்றும் சுற்றுப்பாதைகளின் ஆற்றல் நிலைகள் உள்ளன. அவற்றுக்கும் ஒரு தொகுப்பு அளவு உள்ளது, எனவே சுற்றுப்பாதைகளுக்கு இடையில் இடைநிலை நிலை இல்லை. அவை ஒரு மட்டத்திலிருந்து இன்னொரு நிலைக்குச் செல்கின்றன.
- ஒவ்வொரு சுற்றுப்பாதையிலும் இருக்கும் ஆற்றல் அதன் அளவுடன் தொடர்புடையது. மேலும் சுற்றுப்பாதை அணுவின் கருவில் இருந்து, அதிக ஆற்றலைக் கொண்டுள்ளது.
- ஆற்றல் அளவுகள் வெவ்வேறு எண்ணிக்கையிலான எலக்ட்ரான்களைக் கொண்டுள்ளன. ஆற்றல் மட்டம் குறைவாக, அதில் குறைவான எலக்ட்ரான்கள் உள்ளன. உதாரணமாக, நாம் முதலாம் மட்டத்தில் இருந்தால், இரண்டு எலக்ட்ரான்கள் வரை இருக்கும். நிலை 2 இல், 8 எலக்ட்ரான்கள் வரை இருக்கலாம், எனவே.
- எலக்ட்ரான்கள் ஒரு சுற்றுப்பாதையில் இருந்து இன்னொரு சுற்றுக்கு நகரும்போது, அவை மின்காந்த சக்தியை உறிஞ்சி விடுகின்றன. நீங்கள் இன்னும் ஒரு ஆற்றல்மிக்க மட்டத்திலிருந்து இன்னொரு நிலைக்குச் சென்றால், நீங்கள் அதிக ஆற்றலை வெளியிடுகிறீர்கள், நேர்மாறாகவும்.
இந்த மாதிரி புரட்சிகரமானது மற்றும் முந்தைய மாதிரிகள் இல்லாத பொருளுக்கு ஒரு ஸ்திரத்தன்மையை கொடுக்க முயற்சித்தது. இந்த அணு மாதிரியுடன் வாயுக்களின் தனித்துவமான உமிழ்வு மற்றும் உறிஞ்சுதல் நிறமாலை விளக்கப்பட்டது. அளவீட்டு அல்லது அளவீட்டு என்ற கருத்தை அறிமுகப்படுத்திய முதல் மாதிரி இது. இது போரின் அணு மாதிரியை கிளாசிக்கல் மெக்கானிக்ஸ் மற்றும் குவாண்டம் மெக்கானிக்ஸ் இடையே பாதியிலேயே அமைக்கும் ஒரு மாதிரியாக மாற்றுகிறது. இது குறைபாடுகளைக் கொண்டிருந்தாலும், ஷ்ரோடிங்கர் மற்றும் பிற விஞ்ஞானிகளின் பிற்கால குவாண்டம் இயக்கவியலுக்கான முன்னோடி மாதிரியாக இது இருந்தது.
போர் அணு மாதிரியின் வரம்புகள் மற்றும் பிழைகள்
நாங்கள் குறிப்பிட்டுள்ளபடி, இந்த மாதிரியில் சில குறைபாடுகள் மற்றும் பிழைகள் உள்ளன. முதலாவதாக, எலக்ட்ரான்கள் குறிப்பிட்ட சுற்றுப்பாதைகளுக்கு மட்டுமே மட்டுப்படுத்தப்பட வேண்டிய காரணங்களை இது விளக்கவில்லை அல்லது கொடுக்கவில்லை. எலக்ட்ரான்களுக்கு தெரிந்த ஆரம் மற்றும் சுற்றுப்பாதை இருப்பதாக அது நேரடியாக கருதுகிறது. இருப்பினும், இது அவ்வாறு இல்லை. ஒரு தசாப்தம் கழித்து ஹைசன்பெர்க்கின் நிச்சயமற்ற கொள்கை இதை நிரூபித்தது.
இந்த அணு மாதிரியானது ஹைட்ரஜன் அணுக்களில் எலக்ட்ரான்களின் நடத்தையை மாதிரியாகக் கொள்ள முடிந்தாலும், அதிக எண்ணிக்கையிலான எலக்ட்ரான்களைக் கொண்ட உறுப்புகளுக்கு வரும்போது அது அவ்வளவு துல்லியமாக இல்லை. அது ஒரு மாதிரி ஜீமன் விளைவை விளக்குவதில் சிக்கல் உள்ளது. வெளிப்புற மற்றும் நிலையான காந்தப்புலத்தின் முன்னிலையில் நிறமாலை கோடுகள் இரண்டு அல்லது அதற்கு மேற்பட்டதாக பிரிக்கப்படும்போது இந்த விளைவு காணப்படுகிறது.
இந்த மாதிரி கொண்டிருக்கும் பிழைகள் மற்றும் வரம்புகளில் ஒன்று, இது நில நிலை சுற்றுப்பாதையின் கோண வேகத்திற்கு தவறான மதிப்பை வழங்குகிறது. குறிப்பிடப்பட்ட இந்த பிழைகள் மற்றும் வரம்புகள் அனைத்தும் போரின் அணு மாதிரி பல ஆண்டுகளுக்கு பின்னர் குவாண்டம் கோட்பாட்டால் மாற்றப்பட்டது.
இந்த கட்டுரையின் மூலம் நீங்கள் போரின் அணு மாதிரி மற்றும் அறிவியலில் அதன் பயன்பாடுகளைப் பற்றி மேலும் அறியலாம் என்று நம்புகிறேன்.