இன்று நாம் அணுசக்தியை உற்பத்தி செய்ய பயன்படுத்தப்படும் ஒரு ஐசோடோப்பைப் பற்றி பேசப் போகிறோம். அதன் பற்றி டியூட்டீரியம். இது ஹைட்ரஜனின் ஐசோடோப்பு இனங்களில் ஒன்றாகும் மற்றும் இது டி அல்லது சின்னத்தால் குறிக்கப்படுகிறது 2எச். இதற்கு ஹெவி ஹைட்ரஜன் என்ற பொதுவான பெயர் கொடுக்கப்பட்டுள்ளது, ஏனெனில் வெகுஜனமானது புரோட்டானை விட இரண்டு மடங்கு அதிகம். ஒரு ஐசோடோப்பு என்பது ஒரே வேதியியல் தனிமத்திலிருந்து வரும் ஆனால் வேறுபட்ட வெகுஜன எண்ணிக்கையைக் கொண்ட ஒரு இனத்தைத் தவிர வேறில்லை. டியூட்டீரியம் பல்வேறு நோக்கங்களுக்காக பயன்படுத்தப்படுகிறது.
இந்த காரணத்திற்காக, டியூட்டீரியத்தின் அனைத்து குணாதிசயங்கள், கட்டமைப்பு, பண்புகள் மற்றும் பயன்பாடுகள் ஆகியவற்றை உங்களுக்கு தெரிவிக்க இந்த கட்டுரையை அர்ப்பணிக்க உள்ளோம்.
முக்கிய பண்புகள்
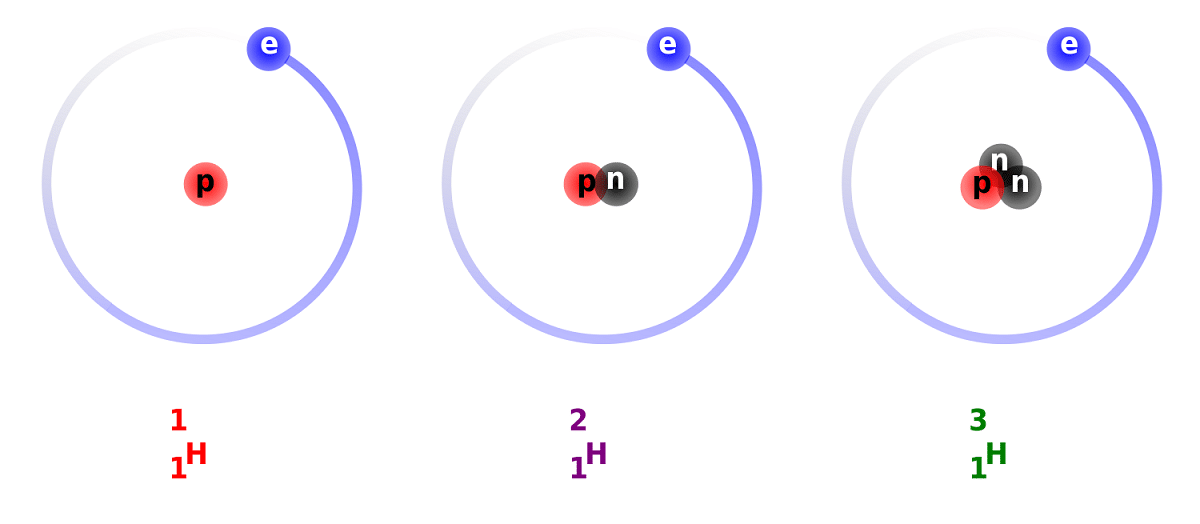
டியூட்டீரியத்திற்கும் ஹைட்ரஜனுக்கும் இடையிலான வேறுபாடு, அது கொண்டிருக்கும் நியூட்ரான்களின் எண்ணிக்கையில் உள்ள வேறுபாடு காரணமாகும். இந்த காரணத்திற்காக, டியூட்டீரியம் ஒரு நிலையான ஐசோடோப்பாக கருதப்படுகிறது மற்றும் முற்றிலும் இயற்கை தோற்றம் கொண்ட ஹைட்ரஜனால் உருவாகும் சேர்மங்களில் காணப்படுகிறது. அவை இயற்கையான தோற்றம் கொண்டவை என்றாலும், அவை சிறிய விகிதத்தில் நிகழ்கின்றன என்பதை கணக்கில் எடுத்துக்கொள்ள வேண்டும். இது சாதாரண ஹைட்ரஜனுடன் ஒத்த பண்புகளைக் கொண்டுள்ளது, அது பங்கேற்கும் எதிர்வினைகளில் அதை முழுவதுமாக மாற்ற முடியும். இந்த வழியில், அதை சமமான பொருட்களாக மாற்றலாம்.
இதற்கும் பிற காரணங்களுக்காகவும், டியூட்டீரியத்தில் அறிவியலின் பல்வேறு துறைகளில் ஏராளமான பயன்பாடுகள் உள்ளன. தொழில்நுட்பம் மற்றும் தகவல்களில் ஆராய்ச்சி மற்றும் முன்னேற்றங்களுக்கான மிக முக்கியமான கூறுகளில் ஒன்றாக இது பல ஆண்டுகளாக மாறிவிட்டது.
இந்த ஐசோடோப்பின் முக்கிய கட்டமைப்பு ஒரு புரோட்டான் மற்றும் நியூட்ரான் கொண்ட ஒரு கருவுடன் ஆனது. இது சுமார் 2,014 கிராம் அணு எடையைக் கொண்டுள்ளது. இந்த ஐசோடோப்பு 1931 ஆம் ஆண்டில் அமெரிக்காவைச் சேர்ந்த வேதியியலாளர் ஹரோல்ட் சி. யுரே மற்றும் அவரது ஒத்துழைப்பாளர்களான ஃபெர்டினாண்ட் பிரிக்வெட் மற்றும் ஜார்ஜ் மர்பி ஆகியோருக்கு நன்றி தெரிவிக்கப்பட்டது. டியூட்டீரியத்தை அதன் தூய்மையான நிலையில் சந்திப்பதற்கான தயாரிப்பு முதல் முறையாக 1933 இல் வெற்றிகரமாக மேற்கொள்ளப்பட்டது. லித்தியம் டியூட்டரைடு எனப்படும் பெரிய ஸ்திரத்தன்மையை நிரூபிக்கும் ஒரு திடமான கட்டம் பயன்படுத்தத் தொடங்கிய 50 களில் இது ஏற்கனவே உள்ளது. இந்த பொருள் டியூட்டீரியம் மற்றும் ட்ரிடியத்தை அதிக எண்ணிக்கையிலான வேதியியல் எதிர்வினைகளில் மாற்றக்கூடும்.
பொருட்களின் தலைமுறைக்கு ரசாயன எதிர்வினைகளை எளிதாக்கும் ஒரு பொருள் கண்டறியப்படும்போது அறிவியலில் முன்னேற்றம் ஏற்படுகிறது. இந்த அர்த்தத்தில், இந்த ஐசோடோப்பின் மிகுதியை நீங்கள் படித்திருந்தால், சில விஷயங்களை அவதானிக்க முடியும். மாதிரி எடுக்கப்பட்ட பகுதியைப் பொறுத்து நீரில் உள்ள டியூட்டீரியத்தின் விகிதம் சற்று மாறுபடும் என்பது அறியப்படுகிறது. சில ஸ்பெக்ட்ரோஸ்கோபி ஆய்வுகள் உள்ளன எங்கள் விண்மீன் மண்டலத்தில் உள்ள மற்ற கிரகங்களில் இந்த ஐசோடோப்பின் இருப்பை தீர்மானித்துள்ளன. பிற வான உடல்களின் கலவையைப் படிக்க இது மிகவும் முக்கியத்துவம் வாய்ந்தது.
டியூட்டீரியத்தின் கட்டமைப்பு மற்றும் தோற்றம்

டியூட்டீரியம் பற்றிய சில உண்மைகளை நாம் அறியப்போகிறோம். நாம் முன்பு குறிப்பிட்டது போல, ஹைட்ரஜன் ஐசோடோப்புகளுக்கு இடையிலான முக்கிய வேறுபாடு அவற்றின் கட்டமைப்பில் உள்ளது. ஹைட்ரஜன், டியூட்டீரியம் மற்றும் ட்ரிடியம் ஆகியவை வெவ்வேறு அளவு புரோட்டான்கள் மற்றும் நியூட்ரான்களைக் கொண்டுள்ளன, எனவே அவை வெவ்வேறு வேதியியல் பண்புகளைக் கொண்டுள்ளன. மற்ற நட்சத்திர உடல்களுக்குள் இருக்கும் டியூட்டீரியம் தோன்றியதை விட அதிக வேகத்தில் அகற்றப்படுகிறது என்பதையும் நான் மனதில் கொள்ள வேண்டும். நட்சத்திர உடல்களில் டியூட்டீரியம் இருப்பதைப் படிப்பது மிகவும் கடினம் என்பதற்கு இதுவும் ஒரு காரணம்.
இயற்கையின் பிற நிகழ்வுகள் ஒரு சிறிய அளவு டியூட்டீரியத்தை உருவாக்குவதாகக் கருதப்படுகின்றன, எனவே அதன் உற்பத்தி இன்றும் கணிசமான ஆர்வத்தை உருவாக்குகிறது. இயற்கையில் டியூட்டீரியம் இருப்பதைப் பற்றி நாம் முன்னர் குறிப்பிட்ட சதவீதத்திலிருந்து, இது 0.02% ஆக இருக்காது. தொடர்ச்சியான விஞ்ஞான விசாரணைகள், டியூட்டீரியத்திலிருந்து உருவான அணுக்களில் பெரும்பாலானவை இயற்கையாகவே வெடிப்பில் தோன்றியவை, இது பிரபஞ்சத்தின் தோற்றத்திற்கு வழிவகுத்தது பிக் பேங். வியாழன் போன்ற பெரிய கிரகங்களில் டியூட்டீரியம் இருப்பதாக கருதப்படுவதற்கு இது ஒரு முக்கிய காரணம்.
இயற்கையாகவே இந்த ஐசோடோப்பைப் பெறுவதற்கான பொதுவான வழி அவை ஹைட்ரஜனுடன் இணைந்தால் தான். இது நிகழும்போது, இது புரோட்டியம் வடிவத்தில் இணைக்கப்படும். விகிதத்திற்கு இடையில் நிறுவப்பட்ட உறவை அறிந்து கொள்வதில் விஞ்ஞானிகள் ஆர்வமாக உள்ளனர் அறிவியலின் பல்வேறு துறைகளில் டியூட்டீரியம் மற்றும் ஹைட்ரஜன். இது வானியல் அல்லது காலநிலை போன்ற விஞ்ஞானத்தின் கிளைகளில் பரவலாக ஆய்வு செய்யப்படுகிறது. இந்த கிளைகளில் பிரபஞ்சத்தையும் நமது வளிமண்டலத்தையும் அறிந்து கொள்ளவும் புரிந்துகொள்ளவும் சில நடைமுறை பயன்பாடுகள் உள்ளன.
டியூட்டீரியத்தின் பண்புகள்

ஹைட்ரஜனுக்கு சொந்தமான இந்த ஐசோடோப்பின் முக்கிய பண்புகள் என்ன என்பதை நாம் அறியப்போகிறோம். கதிரியக்க பண்புகள் இல்லாத ஐசோடோப்பு என்ன என்பதை அறிவது முதலாவதாகும். இது இயற்கையில் மிகவும் நிலையானது என்று பொருள். பல்வேறு வேதியியல் எதிர்வினைகளில் ஹைட்ரஜனை மாற்ற இது பயன்படுத்தப்படலாம். இயற்கையாகவே பெரிய ஸ்திரத்தன்மையைக் கொண்டிருப்பதன் மூலம், சாதாரண ஹைட்ரஜனுக்கு வேறுபட்ட நடத்தை காட்டுகிறது. உயிர்வேதியியல் தன்மை கொண்ட அனைத்து எதிர்வினைகளிலும் இது நிகழ்கிறது. வேதியியல் எதிர்விளைவுகளில் டியூட்டீரியத்திற்கான ஹைட்ரஜனைப் பரிமாறிக்கொள்வதன் மூலம் அதை அடைய முடியும் என்றாலும், அவை வேறுபட்ட நடத்தைகளைக் கொண்டிருக்கும் என்பதை அறிந்து கொள்ள வேண்டும் என்பதை மாற்றுவதற்கு முன் தெரிந்து கொள்வது அவசியம்.
நீரில் உள்ள இரண்டு ஹைட்ரஜன் அணுக்கள் மாற்றப்படும்போது, கனமான நீர் எனப்படும் ஒரு கலவை பெறப்படலாம். கடலில் இருக்கும் ஹைட்ரஜன் மற்றும் டியூட்டீரியம் வடிவத்தில் உள்ளது இது புரோட்டியம் தொடர்பாக 0,016% விகிதத்தை மட்டுமே கொண்டுள்ளது. பிரபஞ்சத்தில், இந்த ஐசோடோப்பு ஹீலியத்தை உருவாக்குவதற்கு விரைவாக உருகும் போக்கைக் கொண்டுள்ளது. நாம் டியூட்டீரியத்தை அணு ஆக்ஸிஜனுடன் இணைத்தால் அது ஒரு நச்சு இனமாக மாறுவதைக் காண்கிறோம். இது இருந்தபோதிலும், மற்றும் வேதியியல் பண்புகள் அல்லது ஹைட்ரஜனுடன் மிகவும் ஒத்திருக்கிறது.
இந்த ஐசோடோப்பின் மற்றொரு பண்பு என்னவென்றால், அதிக வெப்பநிலையில் டியூட்டீரியம் அணுக்கள் அணு இணைவு செயல்முறைக்கு உட்படுத்தப்படும்போது, அதிக அளவு ஆற்றலை வெளியிட முடியும். இது வெளியேற்றம், எங்கள் கிரகத்தின் அணு இணைவை பொருத்த முடியும் என்பதை நீங்கள் ஆய்வு செய்துள்ளீர்கள். கொதிநிலை, ஆவியாதல் வெப்பம், மூன்று புள்ளி மற்றும் அடர்த்தி போன்ற சில இயற்பியல் பண்புகள் அவை ஹைட்ரஜனை விட அதிகமான அளவுகளைக் கொண்டுள்ளன.
இந்த தகவலுடன் நீங்கள் டியூட்டீரியம் மற்றும் அதன் பண்புகள் பற்றி மேலும் அறியலாம் என்று நம்புகிறேன்.