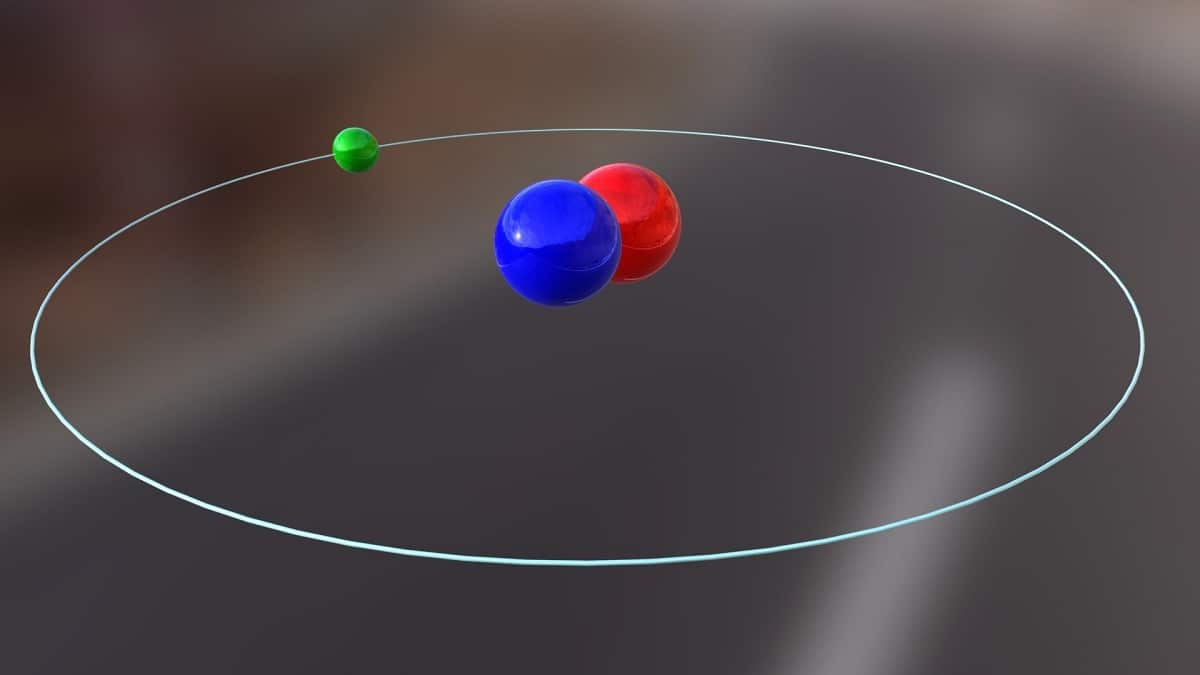
Idag ska vi prata om en isotop som används för att producera kärnenergi. Det handlar om deuterium. Det är en av isotoparterna av väte och representeras av symbolen D eller 2H. Det har fått det vanliga namnet tungt väte eftersom massan är dubbelt så stor som protonen. En isotop är inget annat än en art som kommer från samma kemiska element men har ett annat massnummer. Deuterium används för olika ändamål.
Av den anledningen kommer vi att ägna den här artikeln för att berätta alla egenskaper, struktur, egenskaper och användningsområden för deuterium.
Huvudegenskaper
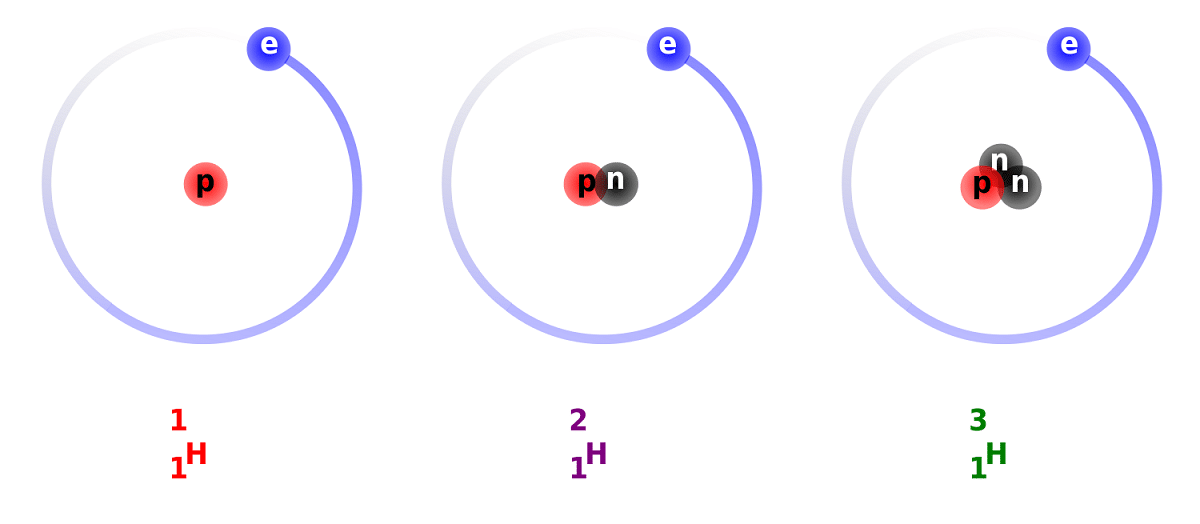
Skillnaden mellan deuterium och väte beror på skillnaden i antalet neutroner som den har. Av denna anledning anses deuterium vara en stabil isotop och kan hittas i föreningar som bildas av väte av helt naturligt ursprung. Man måste ta hänsyn till att de, även om de är av naturligt ursprung, förekommer i en liten andel. Med tanke på egenskaperna har den så mycket som vanligt väte, kan ersätta den i sin helhet i de reaktioner som den deltar i. På detta sätt kan den omvandlas till ekvivalenta ämnen.
Av detta och andra skäl har deuterium ett stort antal applikationer inom olika vetenskapsområden. Det har genom åren blivit ett av de viktigaste elementen för forskning och framsteg inom teknik och information.
Huvudstrukturen för denna isotop består av en kärna som har en proton och en neutron. Den har en atomvikt på cirka 2,014 XNUMX gram. Denna isotop upptäcktes tack vare Harold C. Urey, en kemist från USA, och hans medarbetare Ferdinand Brickwedde och George Murphy, 1931. Förberedelserna för att möta deuterium i dess rena tillstånd genomfördes framgångsrikt för första gången 1933. Det är redan på 50-talet när en fast fas som visade stor stabilitet, så kallad litiumdeuterid, började användas. Detta ämne kan ersätta deuterium och tritium i ett stort antal kemiska reaktioner.
Framsteg inom vetenskapen inträffar när ett ämne hittas som kan underlätta kemiska reaktioner för produktionen. I den meningen, om du studerade överflödet av denna isotop för att kunna observera vissa saker. Det har varit känt att andelen deuterium i vattnet varierar något beroende på det område där provet tas. Det finns några spektroskopi studier som har bestämt förekomsten av denna isotop på andra planeter i vår galax. Detta kan vara av stor betydelse för att studera sammansättningen av andra himmelkroppar.
Deuteriums struktur och ursprung

Vi kommer att få veta några fakta om deuterium. Som vi nämnde tidigare ligger huvudskillnaden mellan väteisotoper i deras struktur. Och är att väte, deuterium och tritium har olika mängder protoner och neutroner, så de har olika kemiska egenskaper. Jag måste också komma ihåg att deuterium som finns i andra stjärnkroppar elimineras med högre hastighet än det har sitt ursprung. Detta är en av anledningarna till att det är så svårt att studera närvaron av deuterium i stjärnkroppar.
Andra naturfenomen anses utgöra en liten mängd deuterium, så dess produktion fortsätter att generera stort intresse idag. Från den procentsats som vi tidigare har nämnt om förekomsten av deuterium i naturen, det uppgår inte till 0.02%. En serie vetenskapliga undersökningar har avslöjat att de allra flesta atomer som har bildats av deuterium naturligt har sitt ursprung i explosionen som gav upphov till universums ursprung som kallas Big Bang. Detta är en av de främsta anledningarna till att deuterium anses vara närvarande i stora planeter som Jupiter.
Det vanligaste sättet att få denna isot är naturligt när de kombineras med väte. När detta händer kommer det att kombineras i protiumform. Forskare är intresserade av att veta förhållandet mellan andelen deuterium och väte inom olika vetenskapsområden. Det studeras allmänt inom vetenskapsgrenar som astronomi eller klimatologi. I dessa grenar har det några praktiska verktyg för att känna till och förstå universum och vår atmosfär.
Egenskaper hos deuterium

Vi kommer att få veta vilka huvudegenskaper denna isotop tillhörande väte har. Det första är att veta vad en isotop saknar radioaktiva egenskaper. Det betyder att den är ganska stabil i naturen. Det kan användas för att ersätta väte i olika kemiska reaktioner. Genom att ha stor stabilitet naturligt, visar ett annat beteende än vanligt väte. Detta händer i alla reaktioner som har en biokemisk natur. Det är nödvändigt att veta innan man byter ut, att även om det kan nås genom att byta ut väte mot deuterium i kemiska reaktioner, måste det vara känt att de kommer att ha ett annat beteende.
När de två väteatomerna i vatten ersätts kan en förening som kallas tungt vatten erhållas. Väte som finns i havet och är i form av deuterium den har bara en andel på 0,016% i förhållande till protium. I universum har denna isotop en tendens att smälta snabbare för att ge upphov till helium. Om vi kombinerar deuterium med atomärt syre ser vi att det blir en giftig art. Trots detta, och de kemiska egenskaperna eller mycket liknar väte.
En annan av egenskaperna hos denna isotop är att när deuteriumatomer utsätts för kärnfusionsprocess vid höga temperaturer kan stora mängder energi frigöras. Det är utvandringen, du har studerat för att kunna implantera kärnfusionen på vår planet. Vissa fysiska egenskaper som kokpunkt, förångningsvärme, trippelpunkt och densitet de har större storlek än väte.
Jag hoppas att du med den här informationen kan lära dig mer om deuterium och dess egenskaper.