
Visst har du någonsin sett Bohr atommodell. Detta är en ganska viktig upptäckt som denna forskare gjorde för vetenskapen, särskilt elektromagnetism och elektrokemi. Tidigare fanns Rutherford-modellen, som var ganska revolutionerande och mycket framgångsrik, men det fanns vissa konflikter med andra atomlagar som Maxwells och Newtons.
I den här artikeln kommer vi att berätta allt du behöver veta om Bohrs atommodell, samt dess detaljer för att klargöra eventuella tvivel om ämnet.
Problem det hjälpte till att lösa
Som vi nämnde i början av artikeln hjälpte denna atommodell till att lösa vissa konflikter som fanns med andra atomlagar. I den tidigare Rutherford-modellen var vi tvungna att elektroner som rör sig med en negativ elektrisk laddning var tvungna att avge en typ av elektromagnetisk strålning. Detta bör uppfyllas på grund av elektromagnetismens lagar där ute. Denna energiförlust gör att elektronerna reduceras till sin omloppsbana genom att spiral mot centrum. När de nådde centrum kollapsade de och kolliderade med kärnan.
Detta genererade ett teoretiskt problem eftersom det inte kunde kollapsa med atomernas kärna, men elektronernas bana måste vara annorlunda. Detta löstes med Bohr-atommodellen. Det förklarar det elektronerna kretsar runt kärnan i vissa banor som är tillåtna och som har en specifik energi. Energi är proportionell mot Plancks konstant.
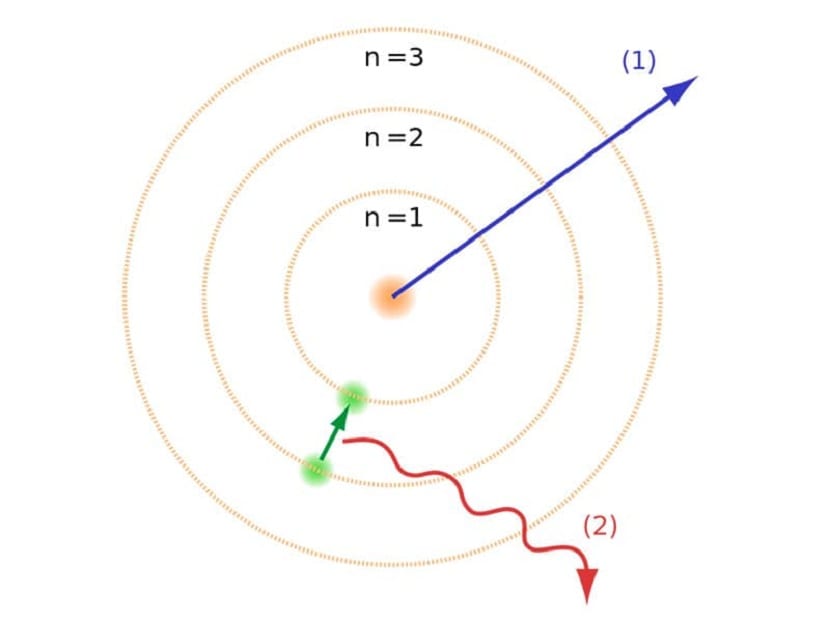
Dessa banor som vi har nämnt var elektroner rör sig kallades energilager eller energinivåer. Det vill säga den energi som elektroner har är inte alltid densamma utan kvantiseras. Kvantnivåer är de olika banorna där atomer är. Beroende på vilken omlopp det befinner sig vid ett visst ögonblick kommer den att ha mer eller mindre energi. Banorna närmare atomens kärna har en större mängd energi. Å andra sidan, ju mer de rör sig bort från kärnan, desto mindre energi.
Energinivåmodell
Denna Bohr-atommodell, som antydde att elektroner bara kunde vinna eller förlora energi genom att hoppa från en bana till en annan, hjälpte till att lösa den kollaps som föreslogs av Rutherfords modell. När man går från en energinivå till en annan absorberar eller avger den elektromagnetisk strålning. Det vill säga när du hoppar från en mer laddad energinivå till en mindre laddad, släpper du överflödig energi. Omvänt, när den går från en låg energinivå till en högre, absorberar den elektromagnetisk strålning.
Eftersom denna atommodell är en modifiering av Rutherford-modellen bibehålls egenskaperna hos den lilla centrala kärnan och med den största delen av atomen. Även om elektronernas banor inte är plana som planeterna, kan man säga att dessa elektroner roterar runt sin kärna på ett liknande sätt som planeterna gör runt solen.
Bohrs atommodellprinciper

Vi ska nu analysera principerna för denna atommodell. Det handlar om en detaljerad förklaring av nämnda modell och dess funktion.
- Partiklar som har en positiv laddning De är i låg koncentration jämfört med atomens totala volym.
- Elektroner med negativ elektrisk laddning är de som finns roterande runt kärnan i cirkulära energibanor.
- Det finns energinivåer i banorna genom vilka elektronerna cirkulerar. De har också en fast storlek, så det finns inget mellanliggande tillstånd mellan banor. De går bara från en nivå till en annan.
- Energin som varje bana har är relaterad till dess storlek. Ju längre banan är från atomens kärna, desto mer energi har den.
- Energinivåerna har olika antal elektroner. Ju lägre energinivå, desto färre elektroner innehåller den. Om vi till exempel är på nivå ett kommer det att finnas upp till två elektroner. På nivå 2 kan det finnas upp till 8 elektroner, så vidare.
- När elektroner rör sig från en bana till en annan absorberar eller frigör de elektromagnetisk energi. Om du går från en mer energisk nivå till en annan mindre, släpper du överflödig energi och vice versa.
Denna modell var revolutionerande och försökte ge stabilitet i det material som de tidigare modellerna inte hade. Gasernas diskreta utsläpp och absorption förklarades också med denna atommodell. Det var den första modellen som introducerade begreppet kvantisering eller kvantisering. Detta gör att Bohrs atommodell betraktas som en modell som ligger halvvägs mellan klassisk mekanik och kvantmekanik. Även om det också har brister, var det en föregångarmodell för Schrödingers och andra forskares senare kvantmekanik.
Begränsningar och fel i Bohr-atommodellen
Som vi har nämnt har denna modell också vissa brister och fel. Först och främst förklarar eller motiverar det inte varför elektroner bara behöver begränsas till specifika banor. Det antar direkt att elektroner har en känd radie och bana. Detta är dock inte så. Ett decennium senare Heisenbergs osäkerhetsprincip motbevisade detta.
Även om denna atommodell kunde modellera beteendet hos elektroner i väteatomer, var det inte så exakt när det gäller element med ett högre antal elektroner. Det är en modell som har problem med att förklara Zeeman-effekten. Denna effekt är vad som kan ses när spektrallinjerna delas i två eller fler i närvaro av ett externt och statiskt magnetfält.
Ett annat av de fel och begränsningar som denna modell har är att den ger ett felaktigt värde för marktillståndets vinkelmoment. Alla dessa fel och begränsningar som nämns orsakar att Bohrs atommodell ersattes av kvantteorin år senare.
Jag hoppas att du med den här artikeln kan lära dig mer om Bohrs atommodell och dess tillämpningar inom vetenskapen.