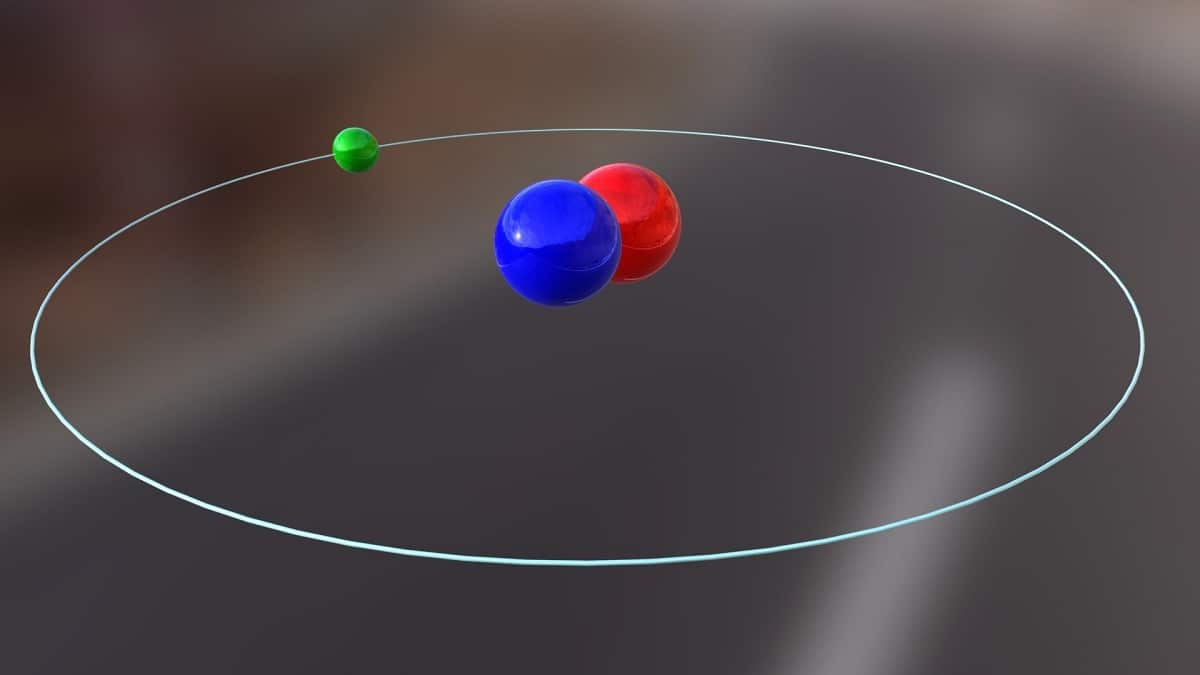
Sot do të flasim për një izotop që përdoret për të prodhuar energji bërthamore. Është rreth deuterium. Isshtë një nga speciet izotopike të hidrogjenit dhe përfaqësohet nga simboli D ose 2H. I është dhënë emri i zakonshëm hidrogjen i rëndë sepse masa është dy herë më e madhe se protoni. Një izotop nuk është asgjë më shumë se një specie që vjen nga i njëjti element kimik por ka një numër tjetër të masës. Deuteriumi përdoret për qëllime të ndryshme.
Prandaj, ne do të kushtojmë këtë artikull për t'ju treguar të gjitha karakteristikat, strukturën, vetitë dhe përdorimet e deuteriumit.
tipare kryesore
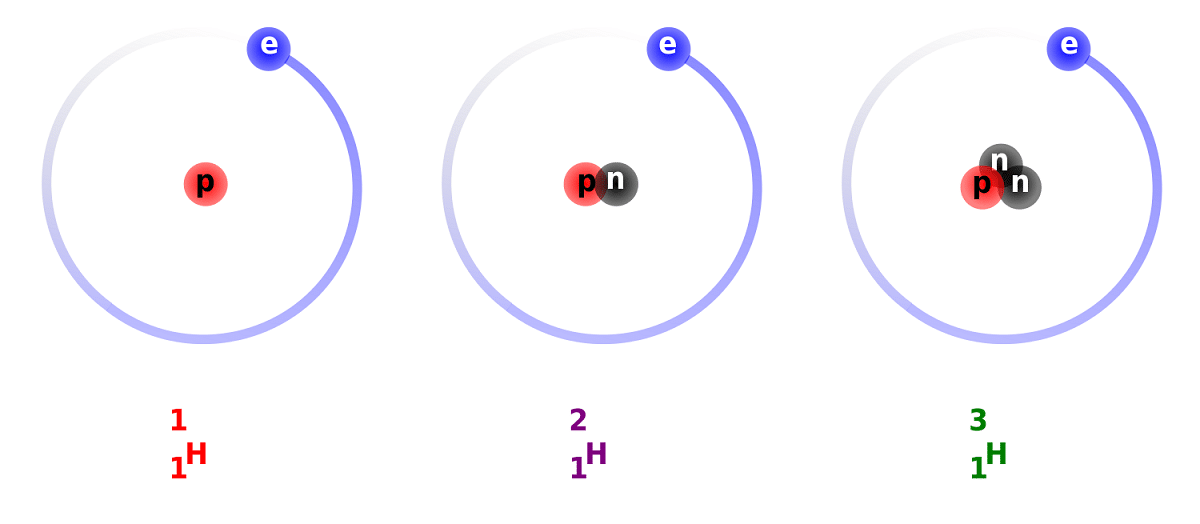
Dallimi midis deuteriumit dhe hidrogjenit është për shkak të ndryshimit në numrin e neutroneve që ka. Për këtë arsye, deuteriumi konsiderohet si një izotop i qëndrueshëm dhe mund të gjendet në përbërjet e formuara nga hidrogjeni me origjinë krejtësisht natyrore. Duhet të merret parasysh që, megjithëse janë me origjinë natyrore, ato ndodhin në një pjesë të vogël. Duke pasur parasysh vetitë që ka aq të ngjashme me hidrogjenin e zakonshëm, mund ta zëvendësojë atë në tërësinë e saj në reagimet në të cilat merr pjesë. Në këtë mënyrë, ai mund të shndërrohet në substanca ekuivalente.
Për këtë dhe arsye të tjera, deuteriumi ka një numër të madh aplikimesh në fusha të ndryshme të shkencës. Me kalimin e viteve ai është bërë një nga elementët më të rëndësishëm për kërkime dhe përparime në teknologji dhe informacion.
Struktura kryesore e këtij izotopi përbëhet nga një bërthamë që ka një proton dhe një neutron. Ka një peshë atomike afërsisht 2,014 gram. Ky izotop u zbulua falë Harold C. Urey, një kimist nga Shtetet e Bashkuara dhe bashkëpunëtorëve të tij Ferdinand Brickwedde dhe George Murphy, në 1931. Përgatitja për të takuar deuteriumin në gjendjen e tij të pastër u krye me sukses për herë të parë në 1933. Alreadyshtë tashmë në vitet 50 kur filloi të përdoret një fazë solide që demonstroi stabilitet të madh, e njohur si litium deuteride. Kjo substancë mund të zëvendësojë deuteriumin dhe tritiumin në një numër të madh të reaksioneve kimike.
Përparimet në shkencë ndodhin kur gjendet një substancë që mund të lehtësojë reagimet kimike për gjenerimin e produkteve. Në këtë kuptim, nëse keni studiuar bollëkun e këtij izotopi për të qenë në gjendje të vëzhgoni disa gjëra. Beenshtë ditur që përqindja e deuteriumit në ujë ndryshon pak në varësi të zonës ku është marrë mostra. Ekzistojnë disa studime të spektroskopisë që kanë përcaktuar ekzistencën e këtij izotopi në planetët e tjerë në galaktikën tonë. Kjo mund të ketë një rëndësi të madhe për të studiuar përbërjen e trupave të tjerë qiellorë.
Struktura dhe origjina e deuteriumit

Ne do të dimë disa fakte rreth deuteriumit. Siç kemi përmendur më parë, ndryshimi kryesor midis izotopeve të hidrogjenit qëndron në strukturën e tyre. Dhe është se hidrogjeni, deuteriumi dhe tritiumi kanë sasi të ndryshme të protoneve dhe neutroneve, kështu që ato kanë veti të ndryshme kimike. Unë gjithashtu duhet të marr parasysh që deuteriumi që ekziston brenda trupave të tjerë yjorë eliminohet me shpejtësi më të madhe sesa është origjinuar. Kjo është një nga arsyet pse është kaq e vështirë të studiohet prania e deuteriumit në trupat yjor.
Fenomene të tjera të natyrës konsiderohet se formojnë një sasi të vogël deuteriumi, kështu që prodhimi i tij vazhdon të gjenerojë interes të konsiderueshëm edhe sot. Nga përqindja që kemi përmendur më parë në lidhje me praninë e deuteriumit në natyrë, nuk arrin në 0.02%. Një seri e hetimeve shkencore kanë zbuluar se shumica dërrmuese e atomeve që janë formuar nga deuteriumi natyrshëm kanë origjinën në shpërthimin që i dha lindjen origjinës së universit të njohur si Big Bang. Këto janë një nga arsyet kryesore pse deuteriumi mendohet të jetë i pranishëm në planet të mëdhenj siç është Jupiteri.
Mënyra më e zakonshme për të marrë këtë izotop natyrisht është kur ato kombinohen me hidrogjen. Kur kjo të ndodhë, ajo do të kombinohet në formën e një protiumi. Shkencëtarët janë të interesuar të dinë marrëdhëniet e vendosura midis proporcionit të deuterium dhe hidrogjen në fusha të ndryshme të shkencës. Isshtë studiuar gjerësisht në degë të shkencës të tilla si astronomia ose klimatologjia. Në këto degë ka disa mjete praktike për të njohur dhe kuptuar universin dhe atmosferën tonë.
Karakteristikat e deuteriumit

Ne do të dimë se cilat janë vetitë kryesore që ka ky izotop që i përket hidrogjenit. Gjëja e parë që duhet të bëni është të dini se çfarë është një izotop pa karakteristika radioaktive. Kjo do të thotë se është mjaft e qëndrueshme në natyrë. Mund të përdoret për të zëvendësuar hidrogjenin në reaksione të ndryshme kimike. Duke patur një stabilitet të madh natyrshëm, tregon një sjellje të ndryshme nga hidrogjeni i zakonshëm. Kjo ndodh në të gjitha reagimet që kanë një natyrë biokimike. Necessaryshtë e nevojshme të dihet para se të zëvendësohet, se megjithëse mund të arrihet duke shkëmbyer hidrogjen me deuterium në reaksione kimike, duhet të dihet se ato do të kenë një sjellje tjetër.
Kur zëvendësoni dy atomet e hidrogjenit në ujë, mund të merrni një përbërje të njohur si ujë i rëndë. Hidrogjeni që është i pranishëm në oqean dhe që është në formën e deuteriumit paraqet vetëm një proporcion prej 0,016% në lidhje me protiumin. Në univers, ky izotop ka një tendencë të shkrihet më shpejt për të krijuar helium. Nëse bashkojmë deuteriumin me oksigjenin atomik shohim se ai bëhet një specie toksike. Përkundër kësaj, dhe vetitë kimike ose shumë të ngjashme me ato të hidrogjenit.
Një tjetër nga vetitë e këtij izotopi është se kur atomet e deuteriumit i nënshtrohen procesit të bashkimit bërthamor në temperatura të larta, sasi të mëdha energjie mund të lirohen. Isshtë eksodi, ju keni studiuar që të jeni në gjendje të zbatoni bashkimin bërthamor të planetit tonë. Disa veti fizike si pika e vlimit, nxehtësia e avullimit, pika e trefishtë dhe dendësia posedojnë madhësi më të mëdha se ato të hidrogjenit.
Shpresoj që me këtë informacion të mësoni më shumë rreth deuteriumit dhe karakteristikave të tij.