V svetu fizike obstaja veja, ki je odgovorna za preučevanje transformacij, ki nastanejo s toploto in delovanjem v sistemu. Gre za termodinamika. Gre za vejo fizike, ki je odgovorna za preučevanje vseh transformacij, ki so le posledica procesov, ki vključujejo spremembe spremenljivk stanja temperature in energije na makroskopski ravni.
V tem članku vam bomo povedali vse, kar morate vedeti o termodinamiki in principih termodinamike.
Glavne značilnosti
Če naredimo analizo klasične termodinamike, vidimo, da temelji na konceptu makroskopskega sistema. Ta sistem ni nič drugega kot del fizične ali konceptualne mase, ki je ločen od zunanjega okolja. Za boljše preučevanje termodinamičnih sistemov se vedno domneva, da gre za fizično maso, ki je ne moti izmenjava energije z zunanjim ekosistemom.
Stanje makroskopskega sistema, kaj je v ravnotežnih pogojih je določena s količinami, imenovanimi termodinamične spremenljivke. Vse te spremenljivke so nam znane in so temperatura, tlak, prostornina in kemična sestava. Vse te spremenljivke določajo sisteme in njihovo ravnotežje. Glavni zapisi v kemijski termodinamiki so bili vzpostavljeni zahvaljujoč mednarodni uniji. S temi enotami je zakon termodinamike mogoče bolje obdelati in razložiti.
Obstaja pa veja termodinamike, ki ne preučuje ravnotežja, ampak je odgovorna za analizo termodinamičnih procesov, za katere so značilni predvsem nima zmožnosti stabilnega doseganja ravnotežnih pogojev.
Zakoni
Načela so v XNUMX. stoletju obsodili Isa, ki so Zadolženi so za urejanje vseh preobrazb in njihovega napredka. Analizirajo tudi, kakšne so resnične meje, da bi lahko resnično pojmovali. So aksiomi, ki jih ni mogoče dokazati, vendar jih na podlagi izkušenj ni mogoče dokazati. Vsaka teorija termodinamike temelji na teh načelih. Ločimo lahko 3 osnovna načela in načelo, toda to je tisto, ki določa temperaturo in je implicitno povezano z ostalimi 3 principi.
Nič zakon
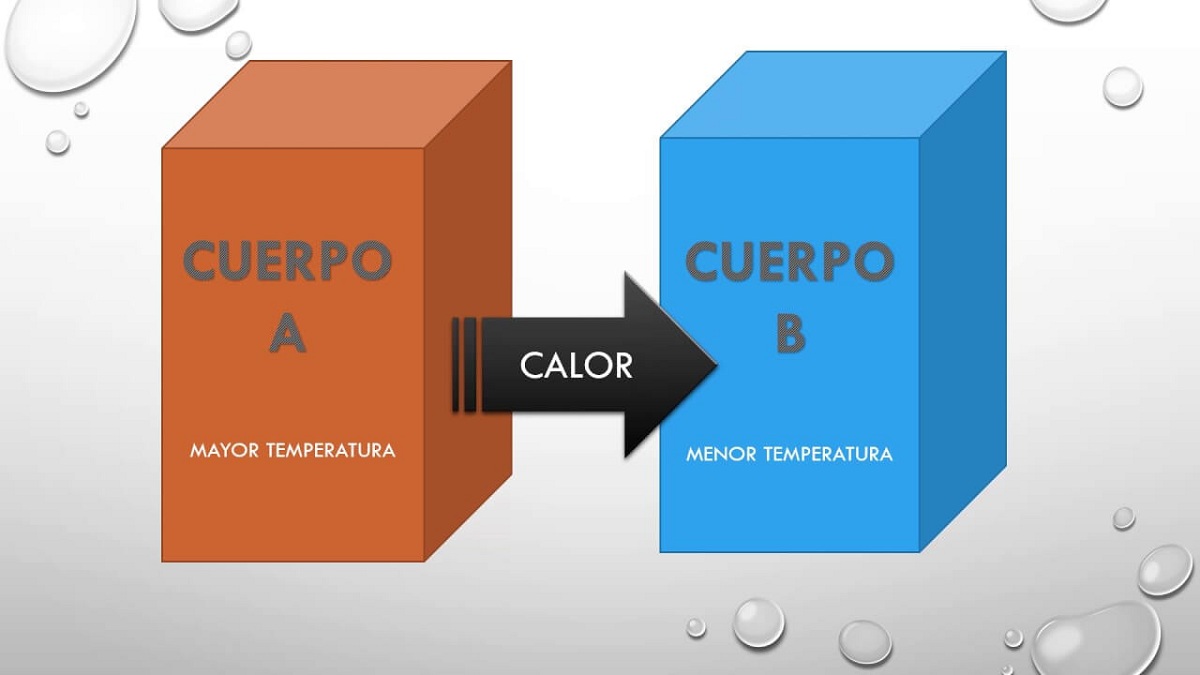
Opisali bomo, kaj je ta ničelni zakon, ki je prvi, ki opisuje temperaturo, ki je implicitna v ostalih načelih. Ko dva sistema medsebojno sodelujeta in sta v toplotnem ravnovesju, si delita nekatere lastnosti. Te lastnosti, ki si jih delijo med seboj, je mogoče izmeriti in jim dati številčno vrednost. Če sta oba sistema v ravnovesju s tretjim, bosta v ravnovesju med seboj in skupna lastnost je temperatura.
Zato to načelo preprosto navaja, da če telo A je bilo v ravnovesju s telesom B in to telo B bo v toplotnem ravnotežju s telesom C, nato pa bosta tudi telesi A in C v ravnovesju toplotno. To načelo pojasnjuje dejstvo, da si lahko dve telesi pri različnih temperaturah izmenjata toploto. Prej ali slej obe telesi dosežeta enako temperaturo, tako da sta v popolnem ravnovesju.
Prvi zakon termodinamike
Ko telo pride v stik s hladnejšim telesom, pride do preobrazbe, ki vodi v stanje ravnovesja. To stanje ravnovesja temelji na dejstvu, da sta temperaturi obeh teles enaki, saj se med vročim telesom in hladnim telesom poveča prenos energije. Da bi razložili ta pojav, so znanstveniki domnevali, da je vroča snov, ki je prisotna v večjih količinah, mimo hladnejšega telesa. Mislili so na tekočino, ki bi se lahko premikala skozi maso, da bi lahko izmenjevala toploto.
To načelo je odgovorno za prepoznavanje toplote kot oblike energije. Ni materialna snov. Na ta način bi lahko pokazali, da sta toplota, ki se meri v kalorijah, in delo, ki se meri v džulih, enakovredni. Zato to danes vemo 1 kalorija je približno 4,186 džuljev.
Lahko rečemo, da je prvo načelo termodinamike načelo ohranjanja energije. Količina energije v toplotnem stroju se pretvori v delo in jo lahko vidi vsak stroj, ki lahko takšno delo proizvede brez porabe energije. To prvo načelo lahko ugotovimo kot: sprememba notranje energije zaprtega termodinamičnega sistema je enaka razliki med toploto, dovajano v sistem, in delom, ki ga sistem opravi v okolju.
Drugi zakon termodinamike
To na začetku navaja, da je nemogoče izdelati cikličen stroj, ki povzroči le prenos toplote iz hladnega telesa v toplo telo. Lahko rečemo, da je nemogoče izvesti preobrazbo, katere rezultat bo le pretvorbo toplote, ki smo jo izvlekli iz enega vira, v mehansko delo.
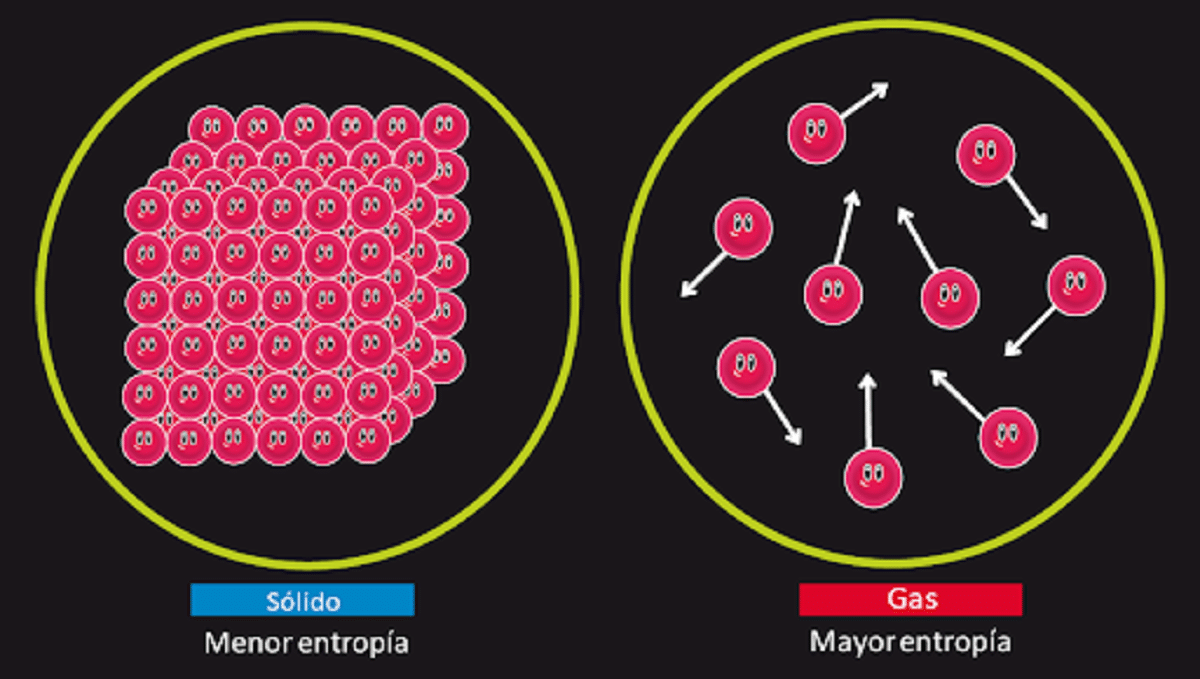
To načelo je zadolženo za zanikanje možnosti, da bi obstajalo znano večno gibanje druge vrste. Vemo, da entropija sistema ostane izoliran nespremenjen, kadar pride do reverzibilne transformacije. Vemo tudi, da se poveča, ko pride do nepovratne preobrazbe.
Tretji zakon termodinamike
To zadnje načelo je tesno povezano z drugim in se šteje kot njegova posledica. To načelo potrjuje, da absolutnega bitja ni mogoče doseči v barvi s končnim številom preobrazb. Vemo, da absolutna ničla ni večja od najnižje temperature, ki jo je mogoče doseči. V enotah Kelvina vemo, da je 0, v stopinjah Celzija pa ima vrednost -273.15 stopinj.
Navaja tudi, da je entropija za trdno snov, ki je popolnoma kristalna s temperaturo 0 kelvina, enaka 0. To pomeni, da entropije ne bi bilo, zato bi bil sistem popolnoma stabilen. Energija sproščanja, prevajanja in vrtenja delcev, ki ga sestavljajo, ne bi bila nič pri temperaturi 0 kelvina.
Upam, da boste s temi informacijami izvedeli več o termodinamiki in osnovnih načelih.