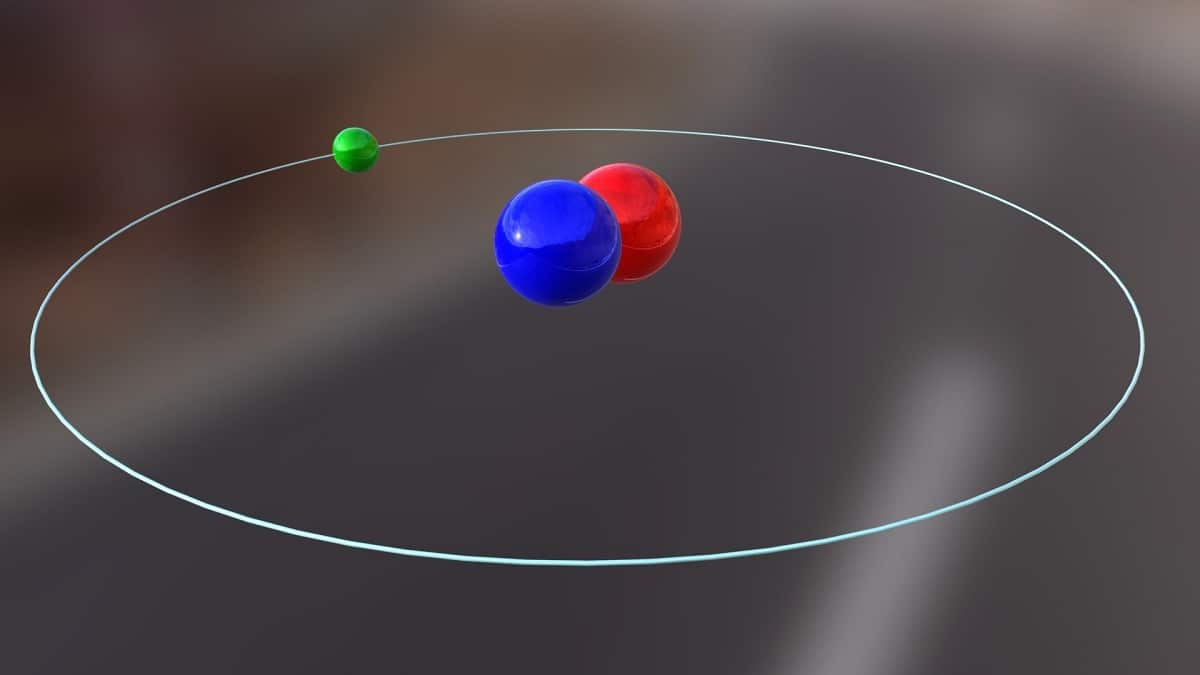
Danes bomo govorili o izotopu, ki se uporablja za proizvodnjo jedrske energije. To je približno devterij. Je ena izmed izotopskih vrst vodika in je predstavljena s simbolom D oz 2H. Dobil je splošno ime težki vodik, ker je masa dvakrat večja od mase protona. Izotop ni nič drugega kot vrsta, ki prihaja iz istega kemičnega elementa, vendar ima drugačno masno število. Devterij se uporablja za različne namene.
Iz tega razloga bomo temu članku posvetili vse značilnosti, strukturo, lastnosti in uporabo devterija.
Glavne značilnosti
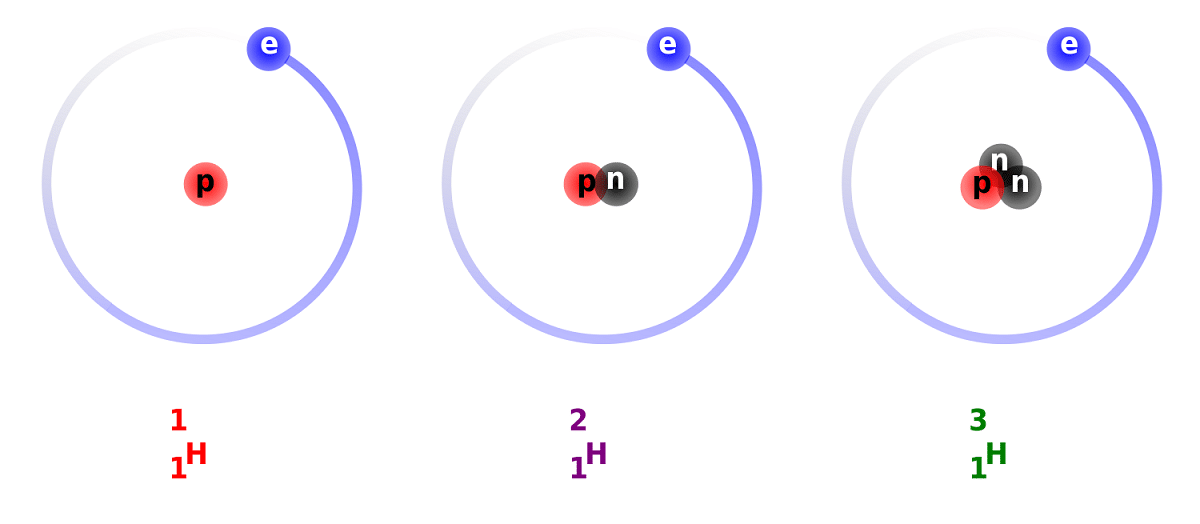
Razlika med devterijem in vodikom je posledica razlike v številu nevtronov, ki jih ima. Zaradi tega se devterij šteje za stabilen izotop in ga lahko najdemo v spojinah, ki jih tvori vodik popolnoma naravnega izvora. Upoštevati je treba, da se, čeprav so naravnega izvora, pojavljajo v majhnem deležu. Glede na lastnosti, ki jih ima tako podobne navadnemu vodiku, ga lahko v celoti nadomesti v reakcijah, v katerih sodeluje. Na ta način se lahko pretvori v enakovredne snovi.
Iz tega in drugih razlogov ima devterij veliko aplikacij na različnih področjih znanosti. Z leti je postal eden najpomembnejših elementov za raziskave in napredek na področju tehnologije in informacij.
Glavno strukturo tega izotopa sestavlja jedro s protonom in nevtronom. Ima atomsko težo približno 2,014 gramov. Ta izotop so odkrili Harold C. Urey, kemik iz ZDA, in njegovi sodelavci Ferdinand Brickwedde in George Murphy leta 1931. Priprava na srečanje z devterijem v čistem stanju je bila prvič uspešno izvedena leta 1933. Že v petdesetih letih se je začela uporabljati trdna faza, ki je pokazala veliko stabilnost, znana kot litijev devterid. Ta snov bi lahko nadomestila devterij in tritij v številnih kemijskih reakcijah.
Napredek v znanosti se zgodi, ko se najde snov, ki lahko olajša kemične reakcije pri nastajanju izdelkov. V tem smislu, če bi preučevali številčnost tega izotopa, da bi lahko opazovali določene stvari. Znano je, da se delež devterija v vodi nekoliko razlikuje, odvisno od območja odvzema vzorca. Obstaja nekaj študij spektroskopije, ki so določili obstoj tega izotopa na drugih planetih v naši galaksiji. To je lahko zelo pomembno za preučevanje sestave drugih nebesnih teles.
Struktura in izvor devterija

Vedeli bomo nekaj dejstev o devteriju. Kot smo že omenili, je glavna razlika med izotopi vodika v njihovi strukturi. In ali imajo vodik, devterij in triti različne količine protonov in nevtronov, zato imajo različne kemijske lastnosti. Upoštevati moram tudi, da se devterij, ki obstaja v drugih zvezdnih telesih, izloča z večjo hitrostjo, kot je izviral. To je eden od razlogov, zakaj je tako težko preučevati prisotnost devterija v zvezdnih telesih.
Šteje se, da drugi naravni pojavi tvorijo majhno količino devterija, zato njegova proizvodnja še danes vzbuja precejšnje zanimanje. Od odstotka, ki smo ga že omenili glede prisotnosti devterija v naravi, ne znaša 0.02%. Niz znanstvenih raziskav je razkril, da je velika večina atomov, ki so nastali iz devterija, naravno nastala v eksploziji, ki je povzročila izvor vesolja, znanega kot Big Bang. To so eden glavnih razlogov, zakaj naj bi bil devterij prisoten na velikih planetih, kot je Jupiter.
Najpogostejši način za pridobitev tega izotopa po naravi je, če jih kombiniramo z vodikom. Ko se to zgodi, se kombinira v obliki protiuma. Znanstvenike zanima poznavanje razmerja med deležem devterija in vodika na različnih področjih znanosti. Veliko se preučuje v vejah, kot sta astronomija ali klimatologija. V teh panogah je nekaj praktičnih pripomočkov za poznavanje in razumevanje vesolja in našega ozračja.
Lastnosti devterija

Vedeli bomo, katere glavne lastnosti ima ta izotop, ki pripada vodiku. Najprej je treba vedeti, kaj je izotop brez radioaktivnih lastnosti. To pomeni, da je v naravi dokaj stabilna. Z njim lahko nadomestimo vodik v različnih kemijskih reakcijah. Z naravno stabilnostjo, kaže drugačno vedenje kot običajni vodik. To se zgodi pri vseh reakcijah, ki imajo biokemično naravo. Pred zamenjavo je treba vedeti, da čeprav je to mogoče doseči z izmenjavo vodika za devterij v kemijskih reakcijah, je treba vedeti, da bodo imeli drugačno vedenje.
Ko zamenjamo dva atoma vodika v vodi, lahko dobimo spojino, znano kot težka voda. Vodik, ki je prisoten v oceanu in je v obliki devterija ima le 0,016% deleža glede na protium. V vesolju se ta izotop nagiba k hitrejšemu zlitju in nastajanju helija. Če združimo devterij z atomskim kisikom, vidimo, da postane strupena vrsta. Kljub temu in kemijskim lastnostim ali zelo podobnim lastnostim vodika.
Druga lastnost tega izotopa je, da se lahko, ko so atomi devterija podvrženi postopku jedrske fuzije pri visokih temperaturah, sprostijo velike količine energije. To je eksodus, preučevali ste, da bi lahko vsadili jedrsko fuzijo našega planeta. Nekatere fizikalne lastnosti, kot so vrelišče, toplota uparjanja, trojna točka in gostota imajo velikosti večje od vrednosti vodika.
Upam, da boste s temi informacijami izvedeli več o devteriju in njegovih značilnostih.